
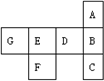
 (2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.
(2010?卢湾区二模)“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77.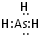
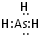
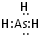 ,同主族自上而下非金属性减弱,非金属性越强气态氢化物越稳定,故PH3更稳定,故答案为:
,同主族自上而下非金属性减弱,非金属性越强气态氢化物越稳定,故PH3更稳定,故答案为: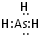 ;PH3;
;PH3;

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com