解:(1)一种阴阳离子均为10电子物质的溶液应为NaOH溶液,则X为Al,Y为Na[Al(OH)
4],Z为Al(OH)
3,
①由以上分析可知Y为Na[Al(OH)
4],故答案为:Na[Al(OH)
4];
②Al可与氧化铁在高温下反应,用于冶炼铁,反应的化学方程式为2Al+Fe
2O
3
Al
2O
3+2Fe,故答案为:2Al+Fe
2O
3
Al
2O
3+2Fe;
③反应Ⅰ为铝和强碱溶液的反应,反应的离子方程式为2Al+2OH
-+6H
2O

2[Al(OH)
4]
-+3H
2↑,
故答案为:2Al+2OH
-+6H
2O

2[Al(OH)
4]
-+3H
2↑;
(2)若Y是一种黄绿色气体,应为Cl
2,X是黑色粉末,应为MnO
2,Z是一种呈碱性的钠的化合物且能用于漂白物质,应为NaClO
①氯气在碱性条件下自身发生氧化还原反应,反应II的离子方程式为Cl
2+2OH
-═Cl
-+ClO
-+H
2O,故答案为:Cl
2+2OH
-═Cl
-+ClO
-+H
2O;
②反应I为MnO
2+4HCl(浓)

MnCl
2+Cl
2↑+2H
2O,若有0.1molMnO
2参加反应,生成Cl
2气体的物质的量为0.1mol,体积是2.24L.
故答案为:2.24L;
(3)X、Y、Z三种物质中含有同一种元素,Z为非金属单质,Y为气体,常见反应为碳酸盐生成二氧化碳,二氧化碳与镁反应生成碳,Z为C,反应II的化学方程式为
CO
2+2Mg

2MgO+C,
故答案为:C; CO
2+2Mg

2MgO+C.
分析:(1)一种阴阳离子均为10电子物质的溶液应为NaOH溶液,则X为Al,Y为Na[Al(OH)
4],Z为Al(OH)
3;
(2)若Y是一种黄绿色气体,应为Cl
2,X是黑色粉末,应为MnO
2,Z是一种呈碱性的钠的化合物且能用于漂白物质,应为NaClO;
(3)X、Y、Z三种物质中含有同一种元素,Z为非金属单质,Y为气体,常见反应为碳酸盐生成二氧化碳,二氧化碳与镁反应生成碳.
点评:本题考查无机物的推断,题目难度不大,本题注意根据反应的转化关系结合物质的相关性质为解答的突破口进行推断,牢固把握元素化合物知识是解答该类题目的前提,学习中注意积累.

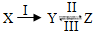
 Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3 Al2O3+2Fe;
Al2O3+2Fe; 2[Al(OH)4]-+3H2↑,
2[Al(OH)4]-+3H2↑, 2[Al(OH)4]-+3H2↑;
2[Al(OH)4]-+3H2↑; MnCl2+Cl2↑+2H2O,若有0.1molMnO2参加反应,生成Cl2气体的物质的量为0.1mol,体积是2.24L.
MnCl2+Cl2↑+2H2O,若有0.1molMnO2参加反应,生成Cl2气体的物质的量为0.1mol,体积是2.24L. 2MgO+C,
2MgO+C, 2MgO+C.
2MgO+C.

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案

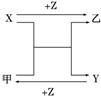 X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系(未注明反应条件),下列说法不正确的是( )
X、Y、Z是中学化学中三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系(未注明反应条件),下列说法不正确的是( )