
 新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
新华社2009年10月15日报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更好更快地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:分析 (1)依据化学方程式和盖斯定律计算得到;
(2)①反应是吸热反应,温度升高平衡正向进行,平衡常数增大;
②依据浓度商和平衡常数比较判断平衡移动的方向;
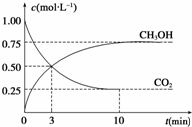
(3)①依据图象分析,达到平衡时物质的浓度变化,结合反应速率概念计算得到;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.依据平衡移动方向分析判断$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$变化;
A.升高温度平衡逆向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
B.再充入H2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
C.再充入CO2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
D.将H2O(g)从体系中分离平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
E.充入He(g),使体系压强增大,分压不变,平衡不动,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$不变;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答 解:(1)①C(s)+1/2O2(g)=CO(g)△H=-126.4kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
依据盖斯定律①-$\frac{②}{2}$+③得到C(s)+H2O(g)=CO(g)+H2(g)△H=+115.4 kJ•mol-1;
则在25℃,101kPa时:C(s)+H2O(g)=CO(g)+H2(g)△H=+115.4 kJ•mol-1;
故答案为:+115.4 kJ•mol-1;
(2)①FeO(s)+CO(g)=Fe(s)+CO2(g)△H>0,温度升高,化学平衡移动后达到新的平衡,平衡正向进行,平衡常数增大,故答案为:增大;
②1100℃时测得高炉中,c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,则在这种情况下,Qc=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.025mol/L}{0.1mol/L}$=0.25<K=0.263;反应未达到平衡,正向进行,故答案为:否;因为Qc=$\frac{c(C{O}_{2})}{c(CO)}$=0.25<K=0.263;
(3)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g),依据图象分析达到平衡后,c(CH3OH)=0.75mol/L,c(CO2)=0.25mol/L,反应消耗的氢气浓度c(H2)=2.25mol/L,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol/(L•min),故答案为:0.225 mol/(L•min);
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.依据平衡移动方向分析判断$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$变化;
A.升高温度平衡逆向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
B.再充入H2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
C.再充入CO2 平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$减小;
D.将H2O(g)从体系中分离平衡正向进行,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$增大;
E.充入He(g),使体系压强增大,分压不变,平衡不动,$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$不变;
故答案为:BD;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
故答案为:5.6×10-5mol/L.
点评 本题考查了热化学方程式和盖斯定律的计算应用,平衡盘点和平衡常数的计算应用,反应速率图象分析判断,影响平衡因素的分析应用,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:多选题
| A. | CaCl2溶液 | B. | Na2SiO3溶液 | C. | Ca(ClO)2的溶液 | D. | 饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纸电池是一种有广泛应用的“软电池”,如图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是( )
纸电池是一种有广泛应用的“软电池”,如图这种碱性纸电池采用薄层纸片作为载体和传导体,纸的两面分别附着锌和二氧化锰.下列有关该纸电池说法不合理的是( )| A. | Zn为负极,进行氧化反应 | |
| B. | 电池工作时,电子由MnO2流向Zn | |
| C. | 正极反应:MnO2+e-+H2O═MnO(OH)+OH- | |
| D. | 电池总反应:Zn+2MnO2+2H2O═Zn(OH)2+2MnO(OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质在人体内发生氧化反应最终均只得到CO2和H2O | |
| B. | 蛋白质溶液中混有少量的NaCl,可加硝酸银溶液后过滤除去杂质 | |
| C. | 在食品包装袋内放入小包装的生石灰和铁粉可以防止食品受潮和变质 | |
| D. | 装修材料如化纤地毯、三合板、大理石等均会释放出污染空气的甲醛气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
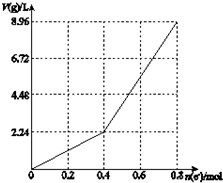
| A. | 电解前CuSO4溶液的物质的量浓度为2 mol/L | |
| B. | 电解后所得溶液中c(H+)=2 mol/L | |
| C. | 当n(e-)=0.6 mol时,V(H2):V(O2)=3:2 | |
| D. | 向电解后的溶液中先后加入16 g CuO和3.6g水,则溶液可恢复为电解前的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取5.85g NaCl固体 | |
| B. | 将称出的固体在容量瓶中充分溶解 | |
| C. | 将烧杯紧靠容量瓶的瓶口转移溶液 | |
| D. | 当液面距离量瓶瓶颈的刻度线下1~2cm时,改用胶头滴管定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA为强酸 | B. | 该混合液pH=7 | ||
| C. | 该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) | D. | 该混合溶液中:c(A-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com