
| A�� | ���¶��µ�ƽ�ⳣ��Ϊ101.25 L/moL | |
| B�� | �ﵽƽ��ʱ��SO2��ת������90% | |
| C�� | �����¶ȣ�����Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶ȴ� | |
| D�� | ��ƽ��������ͨ�����BaCl2��Һ�У��õ�����������Ϊ231.4g |
���� ��������ʵ�������0.45molʱ�����ݷ�Ӧ����ʽ��֪����0.45mol�������μӷ�Ӧ�������������ʼ�����ʵ���Ϊamol����������ʽ������
2SO2��g��+O2��g�� $?_{����}^{����}$2SO3��g��
��ʼ��mol�� a 1.25 0
ת����mol�� 0.9 0.45 0.9
ƽ�⣨mol��a-0.9 0.8 0.9
����ѹǿ֮�ȵ������ʵ���֮����$\frac{a-0.9+0.8+0.9}{a+1.25}$=80%������a=1��
A������ƽ�ⳣ��K=$\frac{{c}^{2}��S{O}_{3}��}{c��{O}_{2}��{c}^{2}��S{O}_{2}��}$�жϣ�
B������ת����=$\frac{��ת�������ʵ���}{��ʼ�����ʵ���}$��100%���㣻
C�����ݽ����¶�ƽ������ȷ�Ӧ�����ƶ��жϣ�
D��ƽ���������������������Ȼ�����Ӧ�������ᱵ�������������Ȼ�����Ӧ���ݴ˼��㣻
��� �⣺��������ʵ�������0.45molʱ�����ݷ�Ӧ����ʽ��֪����0.45mol�������μӷ�Ӧ�������������ʼ�����ʵ���Ϊamol����������ʽ������
2SO2��g��+O2��g�� $?_{����}^{����}$2SO3��g��
��ʼ��mol�� a 1.25 0
ת����mol�� 0.9 0.45 0.9
ƽ�⣨mol��a-0.9 0.8 0.9
����ѹǿ֮�ȵ������ʵ���֮����$\frac{a-0.9+0.8+0.9}{a+1.25}$=80%������a=1��
A������ƽ�ⳣ��K=$\frac{{c}^{2}��S{O}_{3}��}{c��{O}_{2}��{c}^{2}��S{O}_{2}��}$�����÷�Ӧ�����������δ֪��������ƽ�ⳣ������A����
B��SO2��ת����=$\frac{0.9}{1}$��100%=90%����B��ȷ��
C���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ�����������Ӧ���ʼ�С�̶ȱ��淴Ӧ���ʼ�С�̶�С����C����
D��ƽ����������������������ʵ���Ϊ0.9mol�����Ȼ�����Ӧ�������ᱵ������Ϊ209.7g����D����
��ѡB��
���� ���⿼���˻�ѧƽ���з�Ӧ��ת���ʵļ��㡢ƽ����ƶ�����ѧƽ����жϵ�֪ʶ�㣬�ѶȲ���ע������������Ȼ�����Һ��Ӧ�������ᱵ����������������Ȼ�����Һ����Ӧ��Ϊ�״��㣮


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ��c��CH3COO-��=c��Na+����c��H+��=c��OH-��ʱ��һ���Ǵ������ | |
| B�� | ����Һ��c��CH3COO-��=c��Na+��ʱ��һ�����������ƹ��� | |
| C�� | ����Һ��c��CH3COO-��=c��Na+��ʱ����������������ǡ����ȫ��Ӧ | |
| D�� | ����Һ��c��Na+����c��CH3COO-����c��OH-����c��H+��ʱ��һ�����������ƹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��1��ʵ���ҳ���װ��E�Ʊ�Cl2��д���÷�Ӧ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O��
��1��ʵ���ҳ���װ��E�Ʊ�Cl2��д���÷�Ӧ�����ӷ���ʽ��MnO2+4H++2Cl-$\frac{\underline{\;\;��\;\;}}{\;}$Mn2++Cl2��+2H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ϳ���ά���ά�������������ǽ������� | |
| B�� | ���ع��͡���ֹʳ�ã���������T��������������ȡ������������� | |
| C�� | �����ƹ�Ӧ�á������������������ɼ������������������Կ�������Ⱦ | |
| D�� | 2015��10���ҹ���ѧ�������ϻ�ŵ����ҽѧ������ѧ���������֡����Ƶ�ҩ������أ� ��������ű������Чҩ������صķ���ʽΪC15H22O5 ��������ű������Чҩ������صķ���ʽΪC15H22O5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
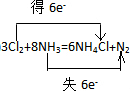 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H6 | B�� | C2H4 | C�� | C2H2 | D�� | C2H6O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=1����ɫ��Һ�У�SO42����Cu2+��Na+��Cl�� | |
| B�� | ������Һ�У�Fe3+��Al3+��NO3����Cl�� | |
| C�� | ��ʹʯ����ֽ����ɫ����Һ�У�Na+��K+��S2����CO32�� | |
| D�� | ˮ�������c��H+��=1��10��12mol•L��1����Һ�У�K+��Na+��Cl����HCO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
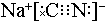 ��̼Ԫ�صĻ��ϼ�Ϊ+2����ClO2����й©���軯�ƣ��õ�����NaCl��N2��CO2��������4��10-5mol•L-1�ķ�ˮ1000L��������ҪClO2������Ϊ2.7g��
��̼Ԫ�صĻ��ϼ�Ϊ+2����ClO2����й©���軯�ƣ��õ�����NaCl��N2��CO2��������4��10-5mol•L-1�ķ�ˮ1000L��������ҪClO2������Ϊ2.7g���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
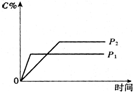 �¶�һ��ʱ��ѹǿ�ֱ�ΪP1��P2�������£�A��g��+2B��g��?nC��g�� �ķ�Ӧ��ϵ�У�C�ķ�����ʱ��t��ѹǿP1��P2�Ĺ�ϵ��ͼ��ʾ�������н�����ȷ���ǣ�������
�¶�һ��ʱ��ѹǿ�ֱ�ΪP1��P2�������£�A��g��+2B��g��?nC��g�� �ķ�Ӧ��ϵ�У�C�ķ�����ʱ��t��ѹǿP1��P2�Ĺ�ϵ��ͼ��ʾ�������н�����ȷ���ǣ�������| A�� | P1��P2��n��3 | B�� | P1��P2��n=3 | C�� | P1��P2��n��3 | D�� | P1��P2��n��3 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com