
| 19.7g |
| 197g/mol |
| 19.7g |
| 197g/mol |
| 1 |
| 3 |
| 1 |
| 30 |
| 1 |
| 30 |
| 2 |
| 15 |
| 4 |
| 3 |
| 38 |
| 15 |
| 2 |
| 15 |
| 38 |
| 15 |


科目:高中化学 来源: 题型:
| A、该AgI胶粒带正电荷 |
| B、该AgI胶粒带负电荷 |
| C、该AgI胶粒电泳时向阳极移动 |
| D、Fe(OH)3胶粒电泳时向阳极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
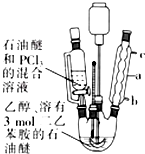
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气是黄绿色的,氯离子是无色的 |
| B、氢气在氯气中燃烧时发出苍白色火焰 |
| C、氯气有毒,新制的氯水有漂白性,而氯离子既无毒也无漂白性 |
| D、氢气和氯气的混合气体只有在强光照射下才能迅速化合生成氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
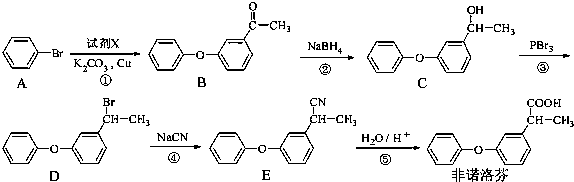
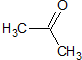 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br| NaOH溶液 |
| △ |
| CH2COOH |
| 浓硫酸,△ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com