
����Ŀ��ij�¶ȣ���2molCO��5 mol H2�Ļ����������ݻ�Ϊ2L���ܱ������У��ڴ����������·�����Ӧ��CO(g)��2H2(g)![]() CH3OH(g)������5min��Ӧ�ﵽƽ�⣬��ʱת�Ƶ���6mol��
CH3OH(g)������5min��Ӧ�ﵽƽ�⣬��ʱת�Ƶ���6mol��
��1��0��5min�ڣ�v(CH3OH)��____
��2��������������䣬�ٳ���2molCO��1.5molCH3OH����ʱv(��)__v(��)(����������������������)��ƽ�ⳣ��Ϊ____��
��3������������������������£�������2molCO��5molH2���ﵽ��ƽ��ʱ��H2�����������ԭƽ��Աȣ�____��
��4����֪CO��H2��һ��������Ҳ�ܺϳ��Ҵ���0.5mol�Ҵ�Һ��ȼ�����ɶ�����̼��ˮ�������ų�������Ϊ617.1kJ/mol����֪H2O��l���TH2O��g������H=+44.2kJ/mol����д���Ҵ�ȼ���ȵ��Ȼ�ѧ����ʽ____��
���𰸡�0.15mol��L��1��min��1 > 3 ��С C2H5OH��l��+3O2��g��=2CO2��g��+3H2O��l�� ��H=��1366.8kJ/mol
��������
(1)ij�¶ȣ���2molCO��5molH2�Ļ����������ݻ�Ϊ2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬���ݻ�ѧ����ʽ��֪ת�Ƶ���4mol����CO���ʵ���Ϊ1mol�����ʱת�Ƶ���6mol������CO���ʵ���=![]() ��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ��(mol) 2 5 0
�仯��(mol) 1.5 3 1.5
ƽ����(mol) 0.5 2 1.5
ƽ��Ũ��c(CO)=![]() =0.25mol/L��c(H2)=
=0.25mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() 0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=
0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=![]() ��
��
(2)ƽ�ⳣ��K=![]() �����Ũ����Qc��K�Ĺ�ϵ�ж�ƽ���ƶ��ķ����ɴ��ƶ�v(��)��v(��)�Ĺ�ϵ��
�����Ũ����Qc��K�Ĺ�ϵ�ж�ƽ���ƶ��ķ����ɴ��ƶ�v(��)��v(��)�Ĺ�ϵ��
(3)�������������������£�������2molCO��5molH2���൱������ѹǿ��ƽ��������У�
(4)�����1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼��Һ̬ˮ�ų��������ٸ�����д�Ȼ�ѧ����ʽ�ķ�����д��
(1)ij�¶ȣ���2molCO��5molH2�Ļ����������ݻ�Ϊ2L���ܱ������У�����5min��Ӧ�ﵽƽ�⣬���ݻ�ѧ����ʽ��֪ת�Ƶ���4mol����CO���ʵ���Ϊ1mol�����ʱת�Ƶ���6mol������CO���ʵ���=![]() ��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
��1mol=1.5mol����ϻ�ѧƽ������ʽ��ʽ���㣻
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ��(mol) 2 5 0
�仯��(mol) 1.5 3 1.5
ƽ����(mol) 0.5 2 1.5
ƽ��Ũ��c(CO)=![]() =0.25mol/L��c(H2)=
=0.25mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() 0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=
0.75mol/L����ϼ״���ʾ�ķ�Ӧ����v(CH3OH)=![]() =
=![]() =0.15mol��L��1��min��1��
=0.15mol��L��1��min��1��
(2)ƽ�ⳣ��K=![]() =
=![]() =3��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc=
=3��������������䣬�ٳ���2molCO��1.5molCH3OH�������ʱŨ����Qc=![]() =
= =1.2��3��˵��ƽ��������У���ʱv(��) ��v(��)��
=1.2��3��˵��ƽ��������У���ʱv(��) ��v(��)��
(3)�������������������£�������2molCO��5molH2���൱������ѹǿ��CO(g)+2H2(g)![]() CH3OH(g)����Ӧ�����������С�ķ�Ӧ��ƽ��������У��ﵽ��ƽ��ʱ��H2�����������ԭƽ��Աȼ�С��
CH3OH(g)����Ӧ�����������С�ķ�Ӧ��ƽ��������У��ﵽ��ƽ��ʱ��H2�����������ԭƽ��Աȼ�С��
(4)1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼����̬ˮ�ų�����Ϊ617.1kJ��![]() =1234.2kJ��1molҺ̬�Ҵ���ȫȼ������3molˮ��3mol��̬ˮת��ΪҺ̬ˮ�ų�������44.2kJ��3=132.6kJ������1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼��Һ̬ˮ�ų�����Ϊ1234.2kJ+132.6kJ=1366.8kJkJ�����Ҵ�ȼ��������̬ˮ���Ȼ�ѧ����ʽΪC2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)��H=-1366.8kJ/mol��
=1234.2kJ��1molҺ̬�Ҵ���ȫȼ������3molˮ��3mol��̬ˮת��ΪҺ̬ˮ�ų�������44.2kJ��3=132.6kJ������1molҺ̬�Ҵ���ȫȼ�����ɶ�����̼��Һ̬ˮ�ų�����Ϊ1234.2kJ+132.6kJ=1366.8kJkJ�����Ҵ�ȼ��������̬ˮ���Ȼ�ѧ����ʽΪC2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)��H=-1366.8kJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������辧�����������״�ṹ����ṹ��ͼ��ʾ��
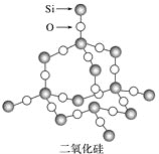
���й��ڶ������辧����״�ṹ��������ȷ����
A. ����������ṹ��Ԫ��O�������ģ�Si����4������
B. ����С�Ļ��ϣ���3��Siԭ�Ӻ�3��Oԭ��
C. ����С�Ļ��ϣ�Si��O��ԭ�Ӹ���֮��Ϊ1��2
D. ����С�Ļ��ϣ���6��Siԭ�Ӻ�6��Oԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҵӷϵ�·����������(��Ҫ������Cu����������Zn��Fe��Pb�Ƚ���)�л���ͭ����ʵ���������£�
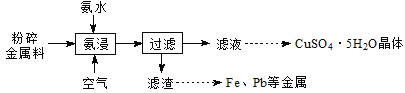
��֪��һ��pH��Χ�ڣ�Cu2+��Zn2+�����백�γ������ӡ�
(1)������������ͼ-1��ʾ��װ���н��С�

�ٹ������������Cu�ɱ���������[Cu(NH3)4] 2+�������ӷ���ʽΪ________��
�ڿ����������ή��CuԪ�صĽ����ʣ���ԭ����_____________��
����������ʱ��ˮ�м���һ����(NH4)2SO4���壬������Cu2+ת��Ϊ[Cu(NH3)4]2+����ԭ����_________��
(2)ϴ���������õ���Һ����������������Һ�ϲ���Ŀ����________________��
(3)��Һ����Ҫ������Ϊ[Cu(NH3)4]2+��NH![]() ��������һ������[Zn(NH3)4]2+������ͭ�������ӵ���ⷴӦ�ɱ�ʾΪ��[Cu(NH3)4]2+(aq)
��������һ������[Zn(NH3)4]2+������ͭ�������ӵ���ⷴӦ�ɱ�ʾΪ��[Cu(NH3)4]2+(aq) ![]() Cu2+(aq) +4NH3(aq)���÷�Ӧ��ƽ�ⳣ������ʽΪ________��ij�л��ܼ�HR�ɸ�Ч��ȡ������Cu2+(ʵ��Cu2+��Zn2+����Ч����)����ԭ��Ϊ(org��ʾ�л���)��Cu2+(aq) + 2HR(org)
Cu2+(aq) +4NH3(aq)���÷�Ӧ��ƽ�ⳣ������ʽΪ________��ij�л��ܼ�HR�ɸ�Ч��ȡ������Cu2+(ʵ��Cu2+��Zn2+����Ч����)����ԭ��Ϊ(org��ʾ�л���)��Cu2+(aq) + 2HR(org) ![]() CuR2(org) + 2H+(org)�������л����м���ϡ���ᣬ����ȡ�õ�CuSO4��Һ��
CuR2(org) + 2H+(org)�������л����м���ϡ���ᣬ����ȡ�õ�CuSO4��Һ��
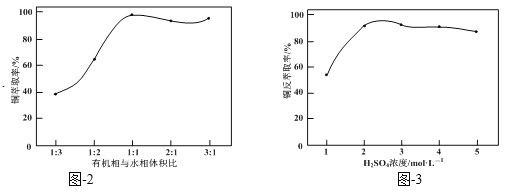
�����ͼ-2����ͼ-3��������������ҺΪԭ�ϣ���ȡ�ϴ���CuSO4��5H2O�����ʵ�鷽����_______������Ũ������ȴ�ᾧ������ϴ�Ӹ��(ʵ���п�ѡ�õ��Լ����л��ܼ�HR��2mol��L1���ᡢ3mol��L1����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A.0.lmolC2H6O�����к�C-H����ĿΪ0.5NA
B.1mol��L-1��NH4Cl��Һ�к���NH4+��ĿС��0.1NA
C.25��ʱ��1LpH=13��Ba(OH)2��Һ�к���OH������ĿΪ0.2NA
D.1molCl2������ͭ���Ͻ�Ӧ��ת�Ƶ�����һ����2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(ClO2)�ǻ���ɫ������ˮ�����壬�۵㣭59�桢�е�11�棬����Ũ�ȹ���ʱ�����ֽ⣬��˳������Ƴ�NaClO2���������������档�ش��������⣺
(1)ʵ������NH4Cl�����ᡢNaClO2(��������)Ϊԭ�ϣ�ͨ�����¹����Ʊ�ClO2��
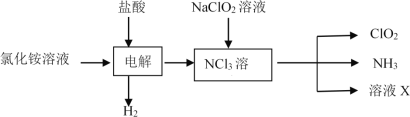
�ٵ��ʱ������Ӧ����ʽΪ__________��
����ҺX�д������ڵ�������__________(�ѧʽ)��
�۳�ȥClO2�е�NH3��ѡ�õ��Լ���_________(����)��
a��ˮ b����ʯ�� c��Ũ���� d������ʳ��ˮ
(2)ʵ�������ù������ⷨ��ClO2�Ʊ���NaClO2���壬��ʵ��װ����ͼ��ʾ��
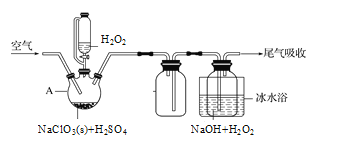
��A�з����ķ�ӦΪ2NaClO3+H2O2+H2SO4=2ClO2��+O2��+Na2SO4+2H2O������A��������_______��
��д���Ʊ�NaClO2����Ļ�ѧ����ʽ��__________����ˮԡ��ȴ��Ŀ����________��
�ۿ������ٹ������������ή��NaClO2�IJ��ʣ���ԭ����______________��
��Ϊ�˲ⶨNaClO2��Ʒ�Ĵ��ȣ�ȡ�����ֲ�Ʒ10.0g����ˮ���1L��Һ��ȡ��10mL����Һ����ƿ�У��ټ��������ữ��KI��Һ����ַ�Ӧ(NaClO2����ԭΪCl-�����ʲ��μӷ�Ӧ)������2��3�ε�����Һ����0.20mol��L-1Na2S2O3��Һ�ζ����ﵽ�ζ����յ�ʱ��ȥ��Һ20.00mL���Լ���NaClO2��Ʒ�Ĵ���_______��(��֪��2Na2S2O3+I2=Na2S4O6+2NaI)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���佺��һ����Ȼ����ҩ����Ҫ���Գɷ�Ϊ�����ᱽ����(I)����ϳ�·�����£�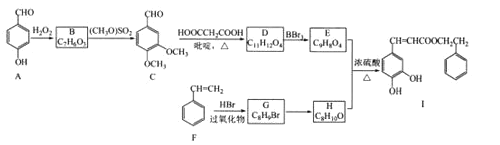
��֪����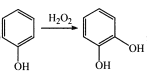 ��
��
��RCHO+HOOCCH2COOH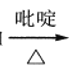 RCH=CHCOOH
RCH=CHCOOH
�۵��ǻ���˫��̼ԭ������ʱ������ת����RCH=CHOH��RCHCHO
�ش��������⣺
(1)������A��������____��F��G�ķ�Ӧ������____��
(2)������B�к��������ŵ�������___��G��H�ķ�Ӧ�����Լ��������ֱ���___��____��
(3)д��������I������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ____��
(4)������W��E��Ϊͬ���칹�壬д����������������W�Ľṹ��ʽ____________��(�����������칹��ֻ��д��2��)
�ٻ�����W��E�����������������Ŀ��ȫ��ͬ���ұ�������3��ȡ������
�ڻ�����W�����б�������2�ֲ�ͬ��ѧ�������⡣
(5)�����CH3CH=CH2��HOOCCH2COOHΪԭ���Ʊ�CH3CH2CH=CHCOOH�ĺϳ�·��(���Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪ��![]() )_____
)_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����8HNO3(ϡ)��3Cu��3Cu(NO3)2��2NO����4H2O��Ӧ��
(1)��������ѧ����ʽ����˫���ű�������ת�Ƶķ������Ŀ________��
(2)___������������Ӧ��____����������(��Ԫ�ط��Ż�ѧʽ)
(3)������Ӧ�У���ԭ���������������ʵ���֮����___________��������1mol���壬��ת�Ƶĵ�������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A.����ϩ���ϩ�Ĺ�����߷����п��ܴ�����![]() �������ӷ�ʽ
�������ӷ�ʽ
B.������ͱ���������ȥһ����ˮ����������4�ֶ���
C.�����ʵ����ı��ͱ�������ȫȼ�������������������
D.![]() ��
��![]() ������ͨ�����۷�Ӧ��ȡ
������ͨ�����۷�Ӧ��ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�ӦCO��g��+H2O��g��![]() CO2��g��+H2��g�����¶�t1ʱ�ﵽƽ�⣬c1��CO����c1��H2O����1��0 mol��L-1����ƽ�ⳣ��ΪK1�������������䣬���߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2��CO����c2��H2O����ƽ�ⳣ��ΪK2����
CO2��g��+H2��g�����¶�t1ʱ�ﵽƽ�⣬c1��CO����c1��H2O����1��0 mol��L-1����ƽ�ⳣ��ΪK1�������������䣬���߷�Ӧ��ϵ���¶���t2ʱ����Ӧ���ƽ��Ũ�ȷֱ�Ϊc2��CO����c2��H2O����ƽ�ⳣ��ΪK2����
A��������CO��Ũ�ȣ�K2 ��K1������ B��K2 ��K1
C��c2��CO����c2��H2O�� D�� c1��CO��>c2��CO��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com