
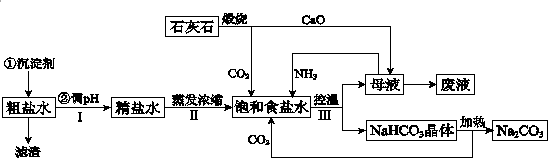
分析 (1)钙离子会与碳酸根离子生成沉淀,镁离子会与氢氧根离子生成沉淀;
(2)生石灰和水反应生成氢氧化钙,氢氧化钙和氯化铵反应生成氨气;
(3)食盐、氨气、水和二氧化碳发生化学反应,生成碳酸氢铵和氯化铵,据此书写化学方程式;
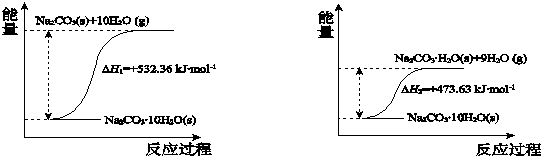
(4)根据碳酸钠晶体失水的能量变化示意图结合热效应解答;
(5)根据Na2CO3+2HCl=2NaCl+H2O+CO2↑进行计算;
(6)原电池的负极失去电子,电解质巍峨熔融碳酸钠,据此写出负极反应式.
解答 解:(1)钙离子会与碳酸根离子生成沉淀:Ca2++CO32-=CaCO3↓,镁离子会与氢氧根离子生成沉淀:Mg2++2OH-=Mg(OH)2↓,所以滤渣的成分除过量的沉淀剂外还有CaCO3、Mg(OH)2,
故答案为:CaCO3、Mg(OH)2;
(2)CaO投入水中生成氢氧化钙,与氯化铵反应产生氨气、氯化钙、水,所以该反应的化学方程式是:2NH4Cl+CaO=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+CaO=CaCl2+2NH3↑+H2O;
(3)因为二氧化碳在水中的溶解度不大,所以先通入氨气,增大溶液的碱性,再通入二氧化碳气体;氨气、二氧化碳与饱和食盐水反应生成氯化铵和碳酸氢钠沉淀,化学方程式是:NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl,
故答案为:NH3;NH3+H2O+CO2+NaCl=NaHCO3↓+NH4Cl;
(4)根据碳酸钠晶体失水的能量变化示意图可知,Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ/mol,Na2CO3•10H2O(s)=Na2CO3•H2O (s)+9H2O(g)△H=+473.63kJ/mol,根据盖斯定律,两式相减Na2CO3•H2O (s) 脱水反应的热化学方程式是Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+532.36kJ/mol-(+473.63kJ/mol)=+58.73 kJ•mol-1,
故答案为:Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73 kJ•mol-1;
(5)产品纯碱中常含有NaCl,取a g混合物与足量稀盐酸充分反应,Na2CO3+2HCl=2NaCl+H2O+CO2↑,得b g固体为NaCl,设碳酸钠的物质的量为X,根据方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1 2
X 2x
混合物质量:117x+a-106X=b,X=$\frac{b-a}{11}$mol,该产品中Na2CO3的质量分数:$\frac{106(b-a)}{11a}$×100%,
故答案为:$\frac{106(b-a)}{11a}$×100%.
(6)用熔融碳酸钠作电解质,甲烷燃料电池中,负极发生氧化反应,则甲烷在负极发生氧化反应,失去电子,生成二氧化碳和水,所以负极的电极反应式是CH4-8e-+4CO32-=5CO2+2H2O,
故答案为:CH4-8e-+4CO32-=5CO2+2H2O.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的为解答关键,注意熟练掌握侯氏制碱法的原理、电解原理及离子反应,明确电解原理及离子的放电顺序、离子之间的反应即可解答,题目较为综合,充分考查了学生的化学实验能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
| 阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
| 进料液 | 0.30 | 310 |
| 电解后 | 0.32 | 210 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
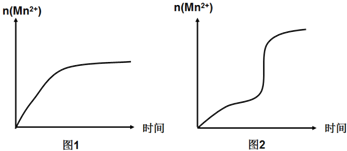
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
| 4 | 3.0 | 2.0 | 2.0 | 3.0 | MnSO4 | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
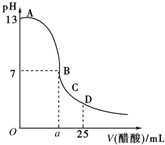 25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )
25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如下图所示,下列分析的结论中正确的是( )| A. | B点的横坐标a=12.5 | |
| B. | C点时溶液中有:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
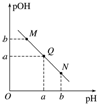
| A. | M点所示溶液的导电能力强于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | Q点水的电离程度在MN直线上最大 | |
| D. | Q点消耗NaOH溶液的体积小于醋酸溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
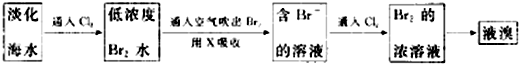
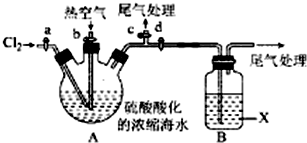

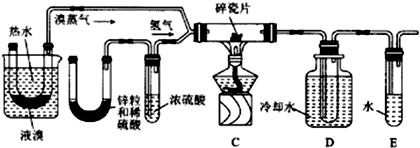
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
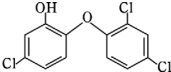 一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )
一种化学名为 2,4,4-三氯-2 羟基-二苯醚的物质(如图),被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用.则下列有关说法中正确的是( )| A. | 该物质苯环上的一溴取代物有 6 种 | |
| B. | 该物质与 FeCl3溶液混合后不显色 | |
| C. | 该物质中所有原子一定处于同一平面 | |
| D. | 物质的分子式为 C12H6Cl3O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量Cu与浓硫酸反应后,向溶液中加入NaNO3,无任何现象 | |
| B. | 实验室检验氨气是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 灼热的铂丝与NH3、O2混合气接触,铂丝持续红热,说明氮的氧化反应是放热反应 | |
| D. | 大气污染气体很难处理,是因为NO等在空气中都能稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com