
(1)工业制硫酸铜的方法很多。
①方法一、用浓硫酸与铜反应制取硫酸铜。该反应的化学方程式是 ,此法的最大缺点是 。
②方法二、用稀硫酸、铜和氧化铁制取硫酸铜,生产的主要过程如下图所示: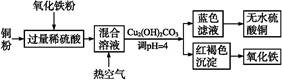
稀硫酸、铜和氧化铁反应的化学方程式是 ;向混合溶液中通入热空气的反应的离子方程式是 ;由滤液得到无水硫酸铜的实验操作是 。
(2)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。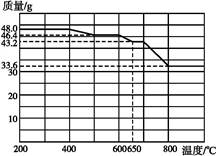
根据图像推断670 ℃时Fe2O3还原产物的化学式为 ,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论) 。
仪器自选。可供选择的试剂:稀硫酸、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
科目:高中化学 来源: 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。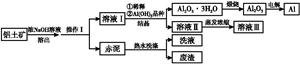
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
烧结法制氧化铝生产过程如下: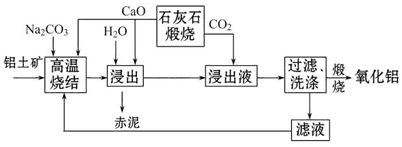
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有100 mL NaOH溶液,先向其中逐渐通入一定量的CO2,随后向此溶液中逐滴加入4 mol/L的盐酸溶液,产生的CO2气体体积(标准状况下)与所加入盐酸溶液的体积之间的关系如图所示,试求: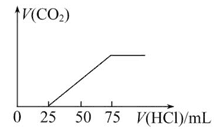
(1)NaOH在吸收CO2气体后,所得溶液中存在的溶质是:________,其物质的量是________。
(2)在加入盐酸情况下产生的CO2气体体积为(标准状况)________。
(3)原NaOH溶液的物质的量浓度是______________________________________;
若以Na2O2固体溶于水配得100 mL该溶液需Na2O2__________________________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
100ml 2mol/LNaOH溶液中通入一定量的CO2,反应后溶液中Na2CO3和NaHCO3的物质的量浓度之比为1∶2。则:
(1)写出其中生成Na2CO3的反应的离子方程式: 。
(2)生成碳酸氢钠的物质的量为 mol。
(3)若往原NaOH溶液中通入标准状况下的CO2气体1.12L后,再逐滴滴加0.5mol/L的盐酸,至少加入 ml后才会有CO2气体放出(不考虑CO2溶解在水中)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。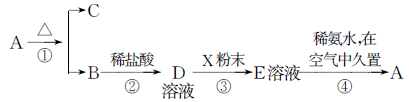
(1)写出下列物质的化学式:
A:__________,B:__________,D:__________,E:__________,X:__________。
(2)写出反应①的化学方程式:________________________________。
写出反应③的离子方程式: ________________________________。
写出反应④过程中,白色沉淀在空气中久置的化学方程式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
则镁铝合金中加NaOH溶液的化学反应方程式为 ,金属X是 ,
固体A的化学式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(2)某兴趣小组为测定镁铝合金中各组成的质量分数,设计图示装置。则仪器甲的名称 ,需要测定的数据有 。(已知该实验时的温度压强)
(3)现有一定量的AlCl3和FeCl3混合溶液,已知其中Al3+、Fe3+的物质的量之和为0.10 mol,若向此溶液加入170 mL 2mol/L NaOH溶液,设Al3+物质的量与总物质的量的比值为x。则x=0.4时,沉淀的物质的量为 mol。请在图中画出沉淀总量(y mol)随x(0→1)变化曲线。 
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
识图绘图是重要的技能。按要求回答下列问题:
(1)向碳酸钠溶液中,逐滴加入盐酸,生成气体的物质的量与加入盐酸体积如甲图所示,则OA段发生反应的离子方程式为________,AB段发生反应的离子方程式为________。
(2)在乙图中补充向澄清石灰水中通入CO2,生成沉淀质量与CO2体积的关系图。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将10.1克过氧化钠和钠的混合物跟120.1克水充分反应后,收集到的气体体积在标准状况下为2.24L。
(1)试分别写出过氧化钠跟水反应的离子、化学方程式 ;(2)计算原混合物中过氧化钠和氧化钠的物质的量之比,n(Na2O2):n(Na)= 。
(3)计算所得溶液的质量分数是多大?ω= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com