
科目:高中化学 来源: 题型:选择题

| A. | 石墨转变为金刚石是吸热反应 | |
| B. | CO(g)+H2O(g)═CO2(g)+H2(g)是吸热反应 | |
| C. | 相同条件下,等质量S(g)和S(s)的能量比较,S(s)较大 | |
| D. | 白磷比红磷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量氯气反应时转移的电子数为3NA | |
| B. | 1L2mol•L-1 K2S溶液中S2-和HS-的总数为2NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜微热反应,转移的电子数为1.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
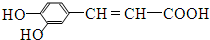 .下列有关咖啡酸的说法中,不正确的是( )
.下列有关咖啡酸的说法中,不正确的是( )| A. | 咖啡酸分子中的所有原子不可能共平面 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1mol咖啡酸可与4 mol Br2发生反应 | |
| D. | 1mol咖啡酸与NaOH溶液反应最多消耗1mol的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,聚乳酸是由单体之间通过加聚而合成
,聚乳酸是由单体之间通过加聚而合成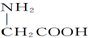 )和丙氨酸(
)和丙氨酸(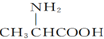 )缩合最多可形成4种二肽
)缩合最多可形成4种二肽 的系统命名法的名称为2,2,3-三甲基戊烷.
的系统命名法的名称为2,2,3-三甲基戊烷.| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
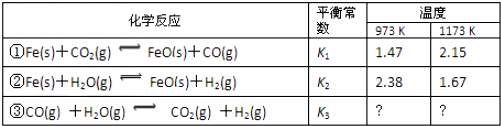
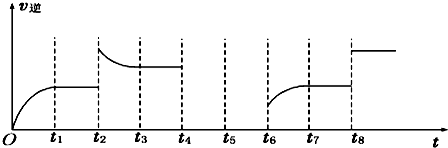
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与石灰水反应:CO2+2OH-═CO32-+H2O | |
| B. | 溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO42-+4H+ | |
| C. | Cu溶于稀硝酸:Cu++2H++NO3-═Cu2++NO2↑+H2O | |
| D. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
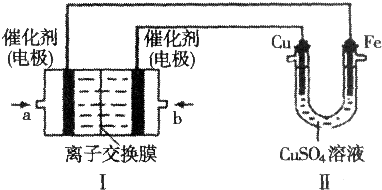
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com