
分析 ①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4;振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀,一定有碳酸银沉淀,可能含有氯化银沉淀,以此来解答.
解答 解:①将部分粉末加入水中,溶液呈无色,说明一定不含有CuSO4;振荡,有白色沉淀生成,说明一定含有Ba(NO3)2、Na2CO3生成碳酸钡白色沉淀;
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,证明是碳酸钡沉淀;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀,一定有碳酸银沉淀,可能含有氯化银沉淀,
(1)上述分析可知一定含有Ba(NO3)2、Na2CO3,一定不含CuSO4,可能含有NaCl,
故答案为:Ba(NO3)2、Na2CO3;CuSO4;NaCl;
(2)过滤需要烧杯、漏斗、玻璃棒,故答案为:烧杯;漏斗;玻璃棒;
(3)②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生,碳酸钡沉淀溶于稀硝酸生成二氧化碳气体,反应离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生,证明生成的是硫酸钡沉淀,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,①中白色沉淀为碳酸钡为突破口,题目难度不大.


科目:高中化学 来源: 题型:推断题
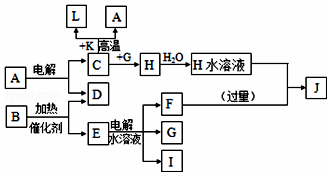 已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图: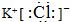
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4LCO2所含的原子数为3NA | |
| B. | 1molCl2与足量的Fe完全反应,转移的电子数为2NA | |
| C. | 0.5molC2H2和C6H6的气态混合物中所含原子总数为2NA | |
| D. | 2L1mol/L的盐酸中所含HCl分子数约为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
. 与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.
与Br2,要想得到纯净的该产物,可用NaOH溶液(或水)洗涤.洗涤后分离粗产品应使用的仪器是分液漏斗.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl固体 | B. | 水 | C. | CaCO3固体 | D. | NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的盐酸和0.1mol/L的氨水等体积混合 | |
| B. | pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 | |
| C. | pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com