
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
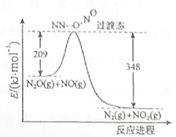 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。
科目:高中化学 来源: 题型:
含C、H、O三种元素的有机物A、B、D,它们的最简式相同。回答下列问题:
(1)在同温同压条件下,同体积的气体A的质量是H2的15倍,1 mol A完全燃烧生成1 mol CO2和1 mol H2O。则A的分子式为________。
(2)有机物B是日常生活中一种调味品的成分。B能和Na2CO3反应放出气体。写出B的同分异构体(能发生银镜反应)的结构简式________________________________________。
(3)有机物D的相对分子质量是A的3倍,D具有酸性,1 mol D与足量Na反应生成22.4 L H2(标准状况)。D在某种催化剂的存在下进行氧化,产物J不发生银镜反应。在浓硫酸存在下,D可发生下列反应:
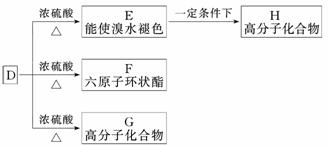
①写出D中官能团的名称:____________________________________________;
②写出J结构简式:__________________________________________________;
③E→H的化学方程式:________________________________________________
_____________________________________________________________________;
④D→F的化学方程式:_________________________________________________
______________________________________________________________________;
⑤D→G的化学方程式:_________________________________________________
______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
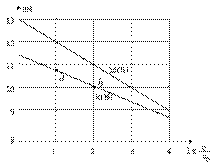 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随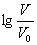 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当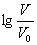 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 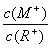 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。
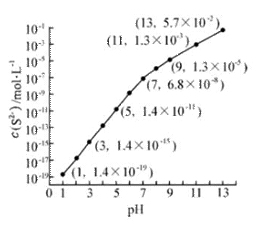
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
|
| 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
合金贮氢材料具有优异的吸收氢性能,在配合氢能的开发中起到重要作用。
(1)一定温度下,某贮氢合金(M)的贮氢过程如图所示,纵轴为平衡时氢气的压强(p),横轴表示固相中氢原子与金属原子的个数比(H/M)。
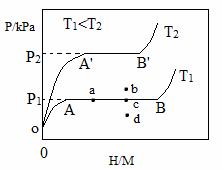
在OA段,氢溶解于M中形成固溶体MHx,随着氢气压强的增大,H/M逐惭增大;在AB段,MHx与氢气发生氢化反应生成氢化物MHy,氢化反应方程式为:zMHx(s)+H2(g)==ZMHy(s) △H(Ⅰ);在B点,氢化反应结束,进一步增大氢气压强,H/M几乎不变。反应(Ⅰ)中z=_____(用含x和y的代数式表示)。温度为T1时,2g某合金4min内吸收氢气240mL,吸氢速率v=______mL•g-1•min。反应的焓变△HⅠ_____0(填“>”“<”或“=”)。
(2)η表示单位质量贮氢合金在氢化反应阶段的最大吸氢量占其总吸氢量的比例,则温度为T1、T2时,η(T1)____η(T2)(填“>”“<”或“=”)。当反应(Ⅰ)处于图中a点时,保持温度不变,向恒容体系中通入少量氢气,达到平衡后反应(Ⅰ)可能处于图中的_____点(填“b”“c”或“d”),该贮氢合金可通过______或_______的方式释放氢气。
(3)贮氢合金ThNi5可催化由CO、H2合成CH4的反应,温度为T时,该反应的热化学方程式为_________。已知温度为T时:CH4(g)+2H2O=CO2(g)+4H2(g) △H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H=-41KJ•mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为()
| A. | 0mL | B. | 0.672mL | C. | 1.34mL | D. | 2.240mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
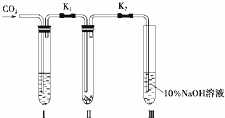
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
实验甲:干燥的二氧化碳和过氧化钠的反应.在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭K1和K2.在试管Ⅰ内装入试剂X后,打开K1和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化.
实验乙:潮湿的二氧化碳和过氧化钠的反应.在试管Ⅰ内装入试剂Y,其他操作同实验甲.观察到木条复燃,且Ⅱ中的淡黄色变为白色.
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭K1和K2的目的是防止.
(2)在实验甲中,试剂X是浓硫酸;在实验乙中,试剂Y是.
(3)根据上述两个实验现象,得到的结论是.
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用(填编号).
A.大理石B.小苏打C.烧碱D.盐酸E.稀硫酸F.稀硝酸.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应中,属于加成反应的是( )
A.CH2===CH2+Br2―→CH2Br—CH2Br
B.CH3CH2OH+3O2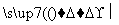 2CO2+3H2O
2CO2+3H2O
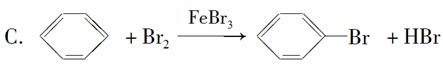
D.CH4+Cl2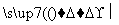 CH3Cl+HCl
CH3Cl+HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com