
| A. | 0.1 mol•L-1 | B. | 0.2 mol•L-1 | C. | 0.4 mol•L-1 | D. | 0.8 mol•L-1 |
分析 反应生成硫酸铝、硫酸铁,硫酸可能有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据钠离子守恒有n(NaOH)=2n(Na2SO4),根据硫酸根守恒有n(Na2SO4)=n(H2SO4),据此计算n(NaOH),再根据c=$\frac{n}{V}$计算.
解答 解:反应生成硫酸铝、硫酸铁,硫酸可能有剩余,向反应后的混合溶液中加入100mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,此时溶液中溶质为Na2SO4,根据硫酸根守恒有n(Na2SO4)=n(H2SO4)=0.4L×0.1mol/L=0.04mol,根据钠离子守恒有n(NaOH)=2n(Na2SO4)=0.08mol,则该c(NaOH)=$\frac{0.08mol}{0.1L}$=0.8mol/L,故选D.
点评 本题考查了混合物的计算,明确最后溶液中的溶质是解本题关键,再结合原子守恒来分析解答,如果考虑每一步反应较麻烦且易出现错误,同时考查学生分析问题及解决问题的能力,题目难度不大.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
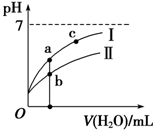 已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数.下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化,下列说法正确的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10 -5 | Ka=3.0×10 -8 | Ka1=4.1×10 -7 Ka2=5.6×10 -11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度大小关系为:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通少量CO2的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c(R-)}{c(HR)•c(OH-)}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度等于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol CO2的体积是22.4L | B. | 1 mol NaCl的质量是58.5 | ||
| C. | H2SO4的摩尔质量是98 g/mol | D. | 1 mol/L NaOH溶液中含有1 molNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )
纳米级二氧化锰的活性很高,以二氧化锰为电极构成的燃料电池如图所示.下列说法不正确的是 ( )| A. | a极为正极,发生还原反应 | |
| B. | b极的电极反应式为(CH2O)n-4ne-+n H2O=nCO2+4n H+ | |
| C. | 电子由b极流出经用电器流向a极 | |
| D. | 放电时H+由质子交换膜左侧向右侧迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧热的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{30MP}^{500℃}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知在120℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242 kJ•mol-1 | |
| D. | 25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ•mol-1,硫酸溶液与氢氧化钾溶液反应的热化学方程式为H2SO4(aq)+2KOH(aq)═K2SO4(aq)+2H2O(l)△H=-57.3 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1则氢气的燃烧热为241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0 则金刚石比石墨的键能大 | |
| C. | 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1则含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
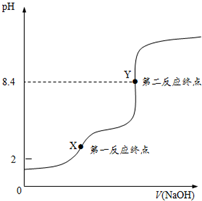 H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.
H2C2O4•2H2O(草酸,二元弱酸)和邻苯二甲酸氢钾均可作为标定NaOH溶液浓度的基准物质,从而获得NaOH标准溶液.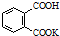 ,摩尔质量为204g•mol-1,易溶于水的固
,摩尔质量为204g•mol-1,易溶于水的固查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com