
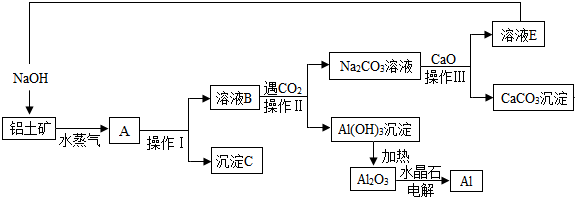
分析 铝土矿中氧化铝和氧化铁,向铝土矿中加入NaOH溶液,发生反应Al2O3+2OH-═2AlO2-+H2O,氧化铁不溶于NaOH溶液,然后过滤,得到溶液B为NaOH、NaAlO2混合溶液,沉淀C为Fe2O3,向溶液B中通入CO2,发生反应2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-、2OH-+CO2=CO32-+H2O,然后过滤得到沉淀Al(OH)3和Na2CO3溶液,向溶液中加入CaO,发生反应Na2CO3+CaO+H2O═2NaOH+CaCO3↓,然后过滤,将NaOH循环利用;将Al(OH)3加热得到Al2O3,电解熔融Al2O3得到Al.
(1)沉淀C为氧化铁;
(2)分离难溶性固体和溶液采用过滤方法;氢氧化铝沉淀吸附硫酸根离子,用盐酸酸化的氯化钡溶液检验硫酸根离子;
(3)煅烧碳酸钙得到CaO和CO2,二者能循环利用.
解答 解:铝土矿中氧化铝和氧化铁,向铝土矿中加入NaOH溶液,发生反应Al2O3+2OH-═2AlO2-+H2O,氧化铁不溶于NaOH溶液,然后过滤,得到溶液B为NaOH、NaAlO2混合溶液,沉淀C为Fe2O3,向溶液B中通入CO2,发生反应2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-、2OH-+CO2=CO32-+H2O,然后过滤得到沉淀Al(OH)3和Na2CO3溶液,向溶液中加入CaO,发生反应Na2CO3+CaO+H2O═2NaOH+CaCO3↓,然后过滤,将NaOH循环利用.将Al(OH)3加热得到Al2O3,电解熔融Al2O3得到Al.
(1)氧化铝能溶于NaOH溶液、氧化铁不溶于NaOH溶液,所以沉淀C为Fe2O3,故答案为:Fe2O3;
(2)分离难溶性固体和溶液采用过滤方法,操作I、操作II、操作III都是用来分离固体和溶液,操作名称是过滤;氢氧化铝沉淀吸附硫酸根离子,用盐酸酸化的氯化钡溶液检验硫酸根离子,其检验方法为取最后一次洗涤液,加入BaCl2溶液,若无白色沉淀,则洗净,
故答案为:过滤;取最后一次洗涤液,加入BaCl2溶液,若无白色沉淀,则洗净;
(3)煅烧碳酸钙得到CaO和CO2,B生成沉淀需要二氧化碳、碳酸钠转化为碳酸钙需要CaO,所以CaO和CO2能循环利用,故答案为:CaO和CO2.
点评 本题考查物质分离和提纯,侧重考查学生分析及知识运用能力,明确物质性质及基本操作方法、反应原理即可解答,知道常见元素化合物知识及常见离子检验方法,题目难度不大.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 能与水反应 | B. | 能与硫酸反应 | ||
| C. | 不能与氢氧化钠反应 | D. | 能与碳酸钠反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
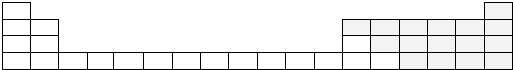
 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | |||
| 4 | K |
 .用电子式表示F元素与J元素形成化合物的过程
.用电子式表示F元素与J元素形成化合物的过程
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体中加入电解质可以产生沉淀,而溶液不能 | |
| C. | 胶体是一种不稳定分散系,而溶液是一种最稳定分散系 | |
| D. | 胶体具有丁达尔效应,而溶液不具有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 湿润的淀粉KI试纸 | B. | 蘸有浓氨水的玻璃棒 | ||
| C. | 湿润的蓝色石蕊试纸 | D. | 湿润的红色石蕊试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
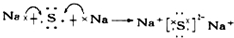 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com