
| A�� | ��ԭ����ɵ�CO2��Ħ�������ɱ�ʾΪ��a+2b��NA | |
| B�� | �ɸ�ԭ����ɵ�CO2Ϊngʱ����������ԭ�Ӹ���Ϊ$\frac{2n}{a+2b}$ | |
| C�� | �ɸ�ԭ����ɵ�CO2Ϊngʱ������ռ�����Ϊ$\frac{22.4n}{a+2b}$L | |
| D�� | ̼������ԭ�ӵ�Ħ������֮��Ϊb��a |
���� ��ij��̼ԭ������Ϊag��ij����ԭ������Ϊbg��NA��ʾ�ɷ��ӵ�������ֵ��
A����ԭ����ɵ�CO2��Ħ����������ֵ�ϵ���NA��Cԭ�Ӻ�2NA��Oԭ��������
B���ɸ�ԭ����ɵ�CO2Ϊngʱ������Ӹ���=$\frac{ng}{��a+2b��g}$��ÿ�������к���2��Oԭ�ӣ��ݴ˼���Oԭ��������
C���¶Ⱥ�ѹǿδ֪��������Ħ�����δ֪�����������������
D��ԭ��Ħ����������ֵ�ϵ���1mol��ԭ��������
��� �⣺��ij��̼ԭ������Ϊag��ij����ԭ������Ϊbg��NA��ʾ�ɷ��ӵ�������ֵ��
A����ԭ����ɵ�CO2��Ħ����������ֵ�ϵ���NA��Cԭ�Ӻ�2NA��Oԭ�����������Ը�ԭ����ɵ�CO2��Ħ�������ɱ�ʾΪ��a+2b��NAg/mol����A����
B���ɸ�ԭ����ɵ�CO2Ϊngʱ������Ӹ���=$\frac{ng}{��a+2b��g}$��ÿ�������к���2��Oԭ�ӣ���Oԭ������Ϊ$\frac{2n}{a+2b}$����B��ȷ��
C���¶Ⱥ�ѹǿδ֪��������Ħ�����δ֪�������������������C����
D��ԭ��Ħ����������ֵ�ϵ���NA����ԭ������������̼������ԭ�ӵ�Ħ������֮��Ϊa��b����D����
��ѡB��
���� ���⿼�����ʵ����йؼ��㣬���ؿ���ѧ�������ж�����������˼ά��������ȷ���ԭ��������Ħ���������㷽���ǽⱾ��ؼ����״�ѡ����AC��ע������Ħ��������÷�Χ��������������Ŀ�ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3CH3+Cl2$\stackrel{��}{��}$CH3CH2Cl+HCl | B�� | 2CH3CHO+O2$��_{��}^{����}$2CH3COOH | ||
| C�� |  +Br2$\stackrel{Fe}{��}$ +Br2$\stackrel{Fe}{��}$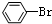 +HBr +HBr | D�� |  +HNO3$��_{50-60��}^{Ũ����}$ +HNO3$��_{50-60��}^{Ũ����}$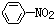 +H2O +H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | PbO2�ǵ�ص����� | |
| B�� | ������ӦʽΪ��Pb+SO42--2e-�TPbSO4 | |
| C�� | PbO2�õ��ӣ������� | |
| D�� | ��طŵ�ʱ����ҺpH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| Ũ�� ʱ�� | c��CO��/mol•L-1 | c��H2��/mol•L-1 | c��CH3OH��/mol•L-1 |
| 0 | 0.8 | 1.6 | 0 |
| 2min | 0.6 | x | 0.2 |
| 4min | 0.3 | 0.8 | 0.5 |
| 6min | 0.3 | 0.8 | 0.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaOH��KOH��Ba��OH��2��Cu��OH��2 | B�� | NaHCO3��KHCO3��Ba��HCO3��2��NH4HCO3 | ||
| C�� | Fe��FeO��Fe2O3��Fe��OH��3 | D�� | KOH��NaOH��RbOH��CsOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�3.2g O2��O3������ԭ����Ϊ0.2NA | |
| B�� | ��״���£�18g H2O��������ԭ����ĿΪNA | |
| C�� | 0.1mol Zn�뺬0.1mol HCl�������ַ�Ӧ��ת�Ƶĵ�����ĿΪ0.2NA | |
| D�� | ��״���£�2.24L CO2�к��е�ԭ����Ϊ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�ͭ��Һ�����۷�Ӧ��Cu2++Fe�TFe3++Cu | |
| B�� | Ba��OH��2��Һ�еμ�NaHSO4��Һ�����ԣ�Ba2++2OH-+2H++SO42-�TBaSO4��+2H2O | |
| C�� | ��NaͶ�뵽CuSO4��Һ��2Na+Cu2+�T2Na++Cu | |
| D�� | �ô����ܽ�CaCO3��CaCO3+2H+�TCa2++H2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com