
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
![]()
项目 | 相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
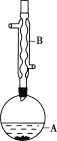
实验步骤:
在A中加入4.4g异戊醇、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。
回答下列问题:
(1)仪器B的名称是___。
(2)在洗涤操作中,第一次水洗和第二次水洗的主要目的分别是___。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后__(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)实验中加入少量无水MgSO4的目的是___。
(5)本实验的产率是___(填标号)。
a.30% b.40% c.60% d.90%
【答案】球形冷凝管 洗掉大部分硫酸和乙酸;洗掉碳酸氢钠溶液 d 干燥(或除去水分) c
【解析】
(1)由装置中仪器B的构造可知,仪器B的名称为球形冷凝管,故答案为:球形冷凝管;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;用饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,故答案为:洗掉大部分硫酸和乙酸;洗掉碳酸氢钠溶液;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待液体下降到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d,故答案为:d;
(4)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对其进行干燥,故答案为:干燥(或除去水分);
(5)乙酸的物质的量为:n=6.0g÷60g/mol=0.1mol,异戊醇的物质的量为:n=4.4g÷88g/mol=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为:3.9g÷130g/mol=0.03mol,所以实验中乙酸异戊酯的产率为:![]() ×100%=60%,所以正确的为c,故答案为:c。
×100%=60%,所以正确的为c,故答案为:c。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
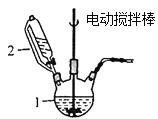
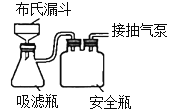
【题目】CuCl用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。
回答以下问题:
(1)图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_________(填“A”或“B”)。
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)如图是体系pH随时间变化关系图:
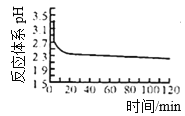
写出制备CuCl的离子方程式_______________;
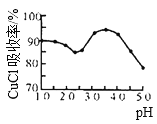
(3)如图是产率随pH变化关系图,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是__________________并维持pH在____________左右以保证较高产率。
(4)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所采用装置如图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是_________________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CaSO4代替O2与燃料CO反应是一种高效、清洁的新型燃烧技术,发生如下反应:
①![]() CaSO4(s)+CO(g)
CaSO4(s)+CO(g) ![]() CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
CaS(s)+CO2(g) ΔH1=-47.3 kJ·mol-1
②CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g) ΔH2=+210.5 kJ·mol-1
③CO(g) ![]() C(s)+
C(s)+![]() CO2(g) ΔH3=-86.2 kJ·mol-1
CO2(g) ΔH3=-86.2 kJ·mol-1
下列说法错误的是 ( )
A. 反应①达到平衡时,增大压强平衡不移动
B. 反应②的平衡常数表达式为K=![]()
C. 反应①和②是主反应,反应③是副反应
D. 2CaSO4(s)+7CO(g) ![]() CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知:Y为地壳中含量最多的元素,M原子的最外层电子数与次外层电数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
(1)M在元素周期表中的位置__;Z+离子的结构示意图为__。
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式__。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__。
(4)实验室制备R的单质,该反应的离子方程式为__。
(5)R非金属性强于M,下列选项中能证明这一事实的是__(填字母序号)。
A.常温下的R单质熔沸点比M单质的高
B.R的氢化物比M的氢化物更稳定
C.一定条件下R和M的单质都能与NaOH溶液反应
D.最高价氧化物对应水化物的酸性强弱:R>M
(6)由X、Y、Z、M四种元素组成的一种弱酸酸式盐A。向A溶液中通入氯气,得到无色溶液,写出该反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述错误的是![]()
化学方程式 | 平衡常数K |
|
|
|
|
|
|
|
|
A.已知1molCO燃烧放出的热为283kJ,![]() ;
;![]() 则
则 表示CO和
表示CO和![]() 生成
生成![]() 和
和![]() 的能量变化
的能量变化
B.常温下![]()
![]() HB溶液和
HB溶液和![]()
![]() 溶液等体积混合后溶液的
溶液等体积混合后溶液的![]() ,则混合溶液中离子浓度的大小顺序为:
,则混合溶液中离子浓度的大小顺序为:![]()
C.常温下,![]() 和
和![]() 反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时
反应生成HX的平衡常数如表所示,仅依据K的变化,就可以说明在相同条件下,平衡时![]() 从
从![]() 到
到![]() 的转化率逐减小,且HX的还原性逐渐减弱
的转化率逐减小,且HX的还原性逐渐减弱
D.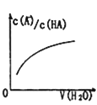 中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中, 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用类推的方法可能会得出错误结论,因此推出的结论需要经过实践的检验才能确定其正确与否。下列有关推论正确的是( )
①BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应
②Fe3O4可以写成FeOFe2O3的形式,Pb3O4也可写成PbOPb2O3的形式
③37℃时,Fe3+能催化H2O2的分解;80℃时,MnO2、过氧化氢酶也能催化H2O2的分解
④电解CuCl2溶液阴极析出Cu,电解AlCl3溶液阴极上析出的是Al
A.0句B.1句C.2句D.3句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应mA(s)+nB(g)![]() eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数将增大
B.该反应的ΔH<0
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com