
| W | X | Y | Z | |
| 结构 或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正价与最低负价之和为零 |

分析 四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素.
(1)主族元素族序数=最外层电子数;
(2)W、X、Y、Z形成的最高价氧化物的水化物分别是硝酸、氢氧化钠、氢氧化铝、硅酸,氢氧化钠和其他三种物质能反应;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度、形成的氯化物溶液酸性强弱等,与得失电子数目多少无关;
②电子层相同、核电荷数越大原子半径越小,原子核对核外电子吸引越强;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,等体积、等浓度的HN3、NaOH溶液恰好反应得到NaN3溶液,NaN3溶液中N3-水解,溶液呈碱性;
(5)镁、铝和稀硫酸反应生成硫酸镁、硫酸铝和氢气,硫酸镁、硫酸铝和氢氧化钠溶液反应生成氢氧化镁、氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,氢氧化镁和氢氧化钠溶液不反应,灼烧氢氧化镁固体,氢氧化镁分解生成氧化镁和水,所以最后所得固体是氧化镁,要确定Al的质量分数,可以计算Al的质量,进而计算其质量分数.
解答 解:四种短周期元素W、X、Y、Z,原子序数依次增大,W最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物,则W为N元素;X焰色反应呈黄色,则X为Na;Y、Z原子序数大于Na,二者处于第三周期,在同周期主族元素形成的简单离子中,Y的离子半径最小,则Y为Al,Z最高正价与最低负价之和为零,则Z为Si元素.
(1)Z是Si元素,最外层电子数为4,处于第ⅣA族,故答案为:ⅣA;
(2)W形成的最高价氧化物的水化物是硝酸,X的最高价氧化物的水化物是氢氧化钠,Y的最高价氧化物的水化物是氢氧化铝,Z的最高价氧化物的水化物是硅酸,氢氧化钠和其他三种物质能反应,所以该元素是Na,故答案为:Na;
(3)①比较金属性强弱的方法有:金属元素最高价氧化物的水化物碱性强弱、金属之间的置换反应、和酸或水反应生成氢气的难易程度、形成的氯化物溶液酸性强弱等,与得失电子数目多少无关,故选:bc;
②电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al,
故答案为:电子层相同,核电荷数Al>Na,原子半径Na>Al,所以原子核对最外层电子的吸引力Na<Al,失电子能力Na>Al;
(4)HN3的酸性与醋酸的相当,则HN3为弱酸,与NaOH发生中和反应,反应方程式为:HN3+NaOH═NaN3+H2O;等体积、等浓度,二者恰好反应,为NaN3溶液,NaN3溶液中N3-水解,溶液呈碱性,故溶液中离子浓度顺序为c(Na+)>c(N3-)>c(OH-)>c(H+),
故答案为:HN3+NaOH═NaN3+H2O;c(Na+)>c(N3-)>c(OH-)>c(H+);
(5)镁、铝和稀硫酸反应生成硫酸镁、硫酸铝和氢气,硫酸镁、硫酸铝和氢氧化钠溶液反应生成氢氧化镁、氢氧化铝,氢氧化铝和氢氧化钠反应生成偏铝酸钠,氢氧化镁和氢氧化钠溶液不反应,灼烧氢氧化镁固体,氢氧化镁分解生成氧化镁和水,所以最后所得固体是氧化镁.
a.根据n的量计算镁的质量,根据m、n计算铝质量,从而计算铝的质量分数,故正确;
b.根据镁、铝的质量及镁铝和稀硫酸反应生成氢气的量计算铝和镁质量,从而计算铝的质量分数,故正确;
c.根据n的质量计算镁的质量,根据镁的量计算镁和稀硫酸反应生成氢气的量,从而得出铝和稀硫酸反应生成氢气的量,故而得出铝的质量分数,故正确,
故选:abc.
点评 本题考查元素周期表及有关推断、实验的设计、分析及评价等,推断元素是解题关键,注意掌握金属性、非金属性强弱比较实验事实,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质 | |
| B. | 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 | |
| C. | 25℃时,Ksp( BaC03)>Ksp( BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 | |
| D. | 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干电池中Zn为负极,炭为正极 | |
| B. | 干电池工作时,电子由Zn极经外电路流向炭极 | |
| C. | 干电池长时间连续使用时内装糊状物可能流出腐蚀电器 | |
| D. | 干电池可以实现化学能向电能的转化和电能向化学能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
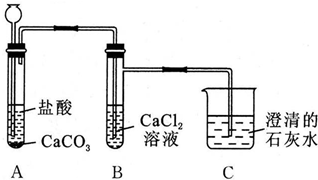
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
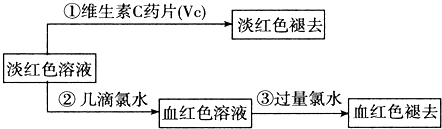
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙酸和乙醇的混合液注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色 | |
| C. | 在试管中注入2 mL CuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀生成 | |
| D. | 向苯酚溶液中滴加几滴稀溴水出现白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com