
SO2和氮氧化物的转化和综合利用既有利于节约资源,又有利于保护环境。
⑴H2还原法是处理燃煤烟气中SO2的方法之一。已知:
2H2S(g)+SO2(g)=3S(s)+2H2O(l) ΔH=a kJ·mol—1
H2S(g)= H2(g)+S(s) ΔH=b kJ·mol—1
H2O(l)= H2O(g) ΔH=c kJ·mol—1
写出SO2(g)和H2(g)反应生成S(s)和H2O(g)的热化学方程式:_____________。
⑵20世纪80年代Townley首次提出利用电化学膜脱除烟气中SO2的技术:将烟气预氧化使SO2转化为SO3,再将预氧化后的烟气利用如图所示原理净化利用。
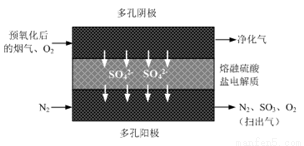
①阴极反应方程式为_____________。
②若电解过程中转移1mol电子,所得“扫出气”用水吸收最多可制得质量分数70%的硫酸_____________g。
⑶利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图Ⅰ、Ⅱ所示。



图Ⅰ 图Ⅱ 图Ⅲ
①由图I知,当废气中的NO含量增加时,宜选用____________法提高脱氮效率。
②图Ⅱ中,循环吸收液加入Fe2+、Mn2+提高了脱氮的效率,其可能原因为_____________。
⑷研究表明:NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图Ⅲ所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。
①温度高于60℃后,NO去除率随温度升高而下降的原因为_____________。
②写出废气中的SO2与NaClO2反应的离子方程式:____________。
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. NaHCO3溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-=CaCO3↓+H2O
B. 用食醋除去热水瓶水垢中CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向氢氧化钡溶液中滴加足量稀硫酸:Ba2++OH-+SO42 -+H+=BaSO4↓+H2O
D. 金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A. 在光照条件下,体积比为1:1的CH4和Cl2充分反应可以制取CH3Cl
B. 乙烯和聚乙烯都可与溴水发生加成反应
C. 按系统命名法,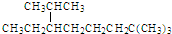 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
D. 分子式同为C3H7Cl,但沸点不同的分子共有两种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
(11分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如图所示,根据图回答下列问题:
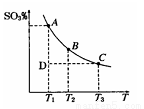
①2SO2(g)+O2(g) 2SO3(g)的△H________0(填“>”或“<”),
2SO3(g)的△H________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是________。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
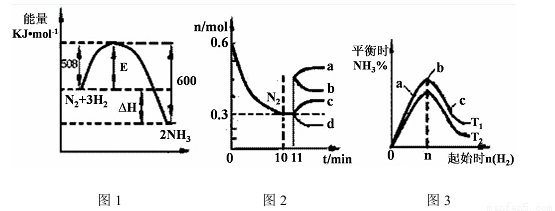
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二下学期第一次月考理科综合化学试卷(解析版) 题型:选择题
下列表格中烷烃的一氯代物只有一种,仔细分析其结构和组成的变化规律,判断第4位烷烃的分子式是( )

A. C53H108 B. C36H72 C. C53H106 D. C36H70
查看答案和解析>>
科目:高中化学 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:选择题
两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g) N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
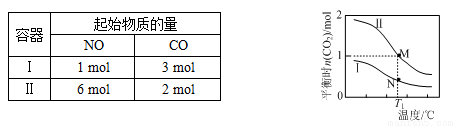
A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目:高中化学 来源:江苏省淮安市2017届高三第三次调研测试化学试卷 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 与Al反应能放H2的溶液中:Cu2+、NH 、CO
、CO 、SO
、SO
B.  =10-12 mol·L-1的溶液中:Mg2+、Fe2+、NO
=10-12 mol·L-1的溶液中:Mg2+、Fe2+、NO 、Cl-
、Cl-
C. 使酚酞变红的溶液中:K+、Na+、I-、AlO
D. 0.1 mol·L-1 FeCl3溶液中:Al3+、Ca2+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省沙市高一下学期第三次双周考(A卷)化学试卷(解析版) 题型:选择题
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )

A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏银川市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下列推论正确的是
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH为正四面体结构,可推测PH 也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com