
为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg—Al | HNO3(浓) | Mg→Al |
| ② | Mg—Al | HCl(aq) | Mg→Al |
| ③ | Mg—Al | NaOH(aq) | Al→Mg |
| ④ | Al—Cu | HNO3(浓) | Cu→Al |
(10分)(1)负极 氧化反应 正极 还原反应
(2)Mg -2e-=Mg2+ 2H+ + 2 e-=H2↑ Mg + 2H+=Mg2+ +H2↑
解析试题分析:(1)根据电子的流向可知,实验1中镁是负极,失去电子,发生氧化反应。而在实验3中铝是负极,失去电子,发生氧化反应。而镁是正极,发生还原反应。
(2)实验2中镁是负极,失去电子,电极反应式是Mg -2e-=Mg2+。铝是正极,溶液中的氢离子得到电子,电极反应式是2H+ + 2 e-=H2↑,因此总的反应式是Mg + 2H+=Mg2+ +H2↑。
考点:考查原电池中电极的判断以及电极反应式的书写
点评:原电池中一般是活泼的金属作负极,不活泼的金属作正极。但在实际判断中,还需要考虑到电解质溶液,例如镁比铝活泼,如果盐酸是电解质溶液,则镁是负极,铝是正极。如果氢氧化钠溶液是电解质溶液,则铝是负极,镁是正极。因此在具体问题中还需要具体分析,灵活运用,且不可生搬硬套。


科目:高中化学 来源:2013-2014学年江西省七校高三上学期第一次联考理综化学试卷(解析版) 题型:填空题
为了探究原电池和电解池的工作原理,某研究性学习小组分别用下图所示的装置进行实验。据图回答问题。

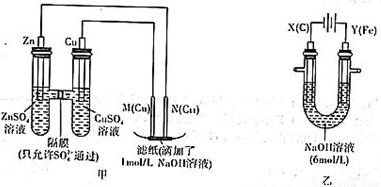
I.用图甲所示装置进行第一组实验时:
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填序号)。
A.石墨 B.镁 C.银 D.铂
(2)实验过程中,SO42− (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象 。
II.该小组同学用图乙所示装置进行第二组实验时发现,两极均有气体产生,且Y极溶液逐渐变成紫红色:停止实验观察到铁电极明显变细,电解液仍然澄清。查阅资料知,高铁酸根(FeO42-)在溶液中呈紫红色。请根据实验现象及所查信息,回答下列问题:
(3)电解过程中,X极溶液的pH (填“增大”“减小”或“不变”)
(4)电解过程中,Y极发生的电极反应为4OH−-4e−=2H2O+O2↑和 。
(5)电解进行一段时间后,若在X极收集到672mL气体,Y电极(铁电极)质量减小0.28g,则在Y极收集到气体为 mL(均已折算为标准状况时气体体积)。
(6)K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电池反应为:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | 电极材料 | 电解质溶液 | 电子流向 |
| ① | Mg—Al | HNO3(浓) | Mg→Al |
| ② | Mg—Al | HCl(aq) | Mg→Al |
| ③ | Mg—Al | NaOH(aq) | Al→Mg |
| ④ | Al—Cu | HNO3(浓) | Cu→Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10′)为了探究原电池的电极名称不仅与电极材料有关还与电解质溶液有关,某学生做了如下的实验
编号 | 电极材料 | 电解质溶液 | 电子流向 |
① | Mg―Al | HNO3(浓) | Mg→Al |
② | Mg―Al | HCl(aq) | Mg→Al |
③ | Mg―Al | NaOH(aq) | Al→Mg |
④ | Al―Cu | HNO3(浓) | Cu→Al |
根据以上表格内容回答:
(1)( 4′)实验1中Mg作___________(填正极或负极),发生__________(氧化反应或还原反应)
实验3中Mg作___________,发生__________(同上)
(2) ( 6′)实验2中Mg电极反应式为__________________。
Al电极上的电极反应式为_________________________,
总的电池反应是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验:
实验一 实验二

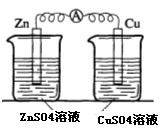


实验三 实验四
结果:
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率): 。
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜极给Cu2+? 。
(3)实验三中盐桥中K+流向 溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3mol/s,则K+的迁移速率为 mol/s。
(4)实验四中电流计指针有偏转,写出铜极的电极反应式: ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com