
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |
分析 A.亚硫酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀和亚硫酸根离子;
B.根据正反应为放热反应,则逆反应为吸热反应及CO气体的燃烧热进行判断;
C.次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子;
D.产生气泡为二氧化碳或NO,颜色变深说明含有碘离子和硝酸根离子,不一定含有碳酸根离子.
解答 解:A.亚硫酸氢根离子的酸性大于氢氧化铝,AlO2-、HSO3-之间反应生成氢氧化铝沉淀,在溶液中不能大量共存,故A错误;
B.CO(g)的燃烧热是283.0 kJ•mol-1,则二氧化碳分解生成一氧化碳气体和氧气时吸收的热量为+566.0 kJ•mol-1,该反应的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+566.0 kJ•mol-1,故B正确;
C.将少量SO2通入NaClO溶液中,二者发生氧化还原反应,正确的离子方程式为:ClO-+SO2+H2O═SO42-+2H++Cl-,故C错误;
D.某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,产生的气体可能为NO或二氧化碳,溶液颜色变深但未见沉淀生成,说明原溶液中含有NO3-、I-,但是不一定CO32-,故D错误;
故选B.
点评 本题考查了离子共存、离子方程式的判断,题目难度中等,涉及离子方程式、离子共存、热化学方程式等知识,明确离子反应发生条件、离子方程式的书写原则为解答关键,试题培养了学生灵活应用基础知识的能力.


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
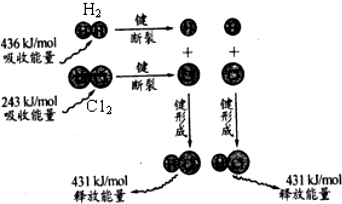
| A. | 该反应在光照和点燃条件下的反应热效应是相同的 | |
| B. | 氢气分子中的化学键比氯气分子中的化学键更稳定 | |
| C. | 2mol气态氢原子的能量低于1mol氢气 | |
| D. | 氢气与氯气反应的热化学方程式:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 1种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
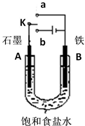
| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 | |
| C. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| D. | 若开始时开关K与b连接,则反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
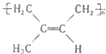 :其1mol单体跟1molBr2发生加成反应生成的产物有3种;
:其1mol单体跟1molBr2发生加成反应生成的产物有3种; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,肉桂醛分子结构中有6种不同化学环境的氢原子.
,肉桂醛分子结构中有6种不同化学环境的氢原子.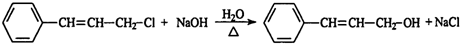 ,B转化为肉桂醛的反应条件为Cu/Ag加热.
,B转化为肉桂醛的反应条件为Cu/Ag加热. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 标准状况下,4.0 g CH4中含有共价键的数目为NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com