

分析 (1)甲醇和甲酸反应生成甲酸甲酯和水;
(2)酯化反应中浓硫酸起到催化剂的作用,甲酸甲酯不溶于饱和碳酸钠,且碳酸钠可与甲酸反应;
(3)甲醇(CH3OH)易挥发,且有毒;冷凝管应从下口进水,上口出水;
(4)甲醇是有毒的易挥发的有机物,应在密闭容器中进行.
解答 解:(1)甲酸和甲醇进行酯化反应的历程是羧酸脱羟基醇脱氢,甲醇和甲酸反应生成甲酸甲酯和水,化学方程式为:HCOOH+CH3OH$?_{△}^{浓硫酸}$HCOOCH3+H2O,
故答案为:HCOOH+CH3OH$?_{△}^{浓硫酸}$HCOOCH3+H2O;
(2)酯化反应中浓硫酸起到催化剂的作用,甲酸甲酯不溶于饱和碳酸钠,且碳酸钠可与甲酸反应,甲醇易溶于水,便于分层,所以饱和碳酸钠的作用为中和挥发出来的甲酸,使之转化为甲酸钠溶于水中,溶解挥发出来的甲醇,降低甲酸甲酯在水中的溶解度,便于分层得到酯,
故答案为:催化;中和挥发出来的甲酸,使之转化为甲酸钠溶于水中,溶解挥发出来的甲醇,降低甲酸甲酯在水中的溶解度,便于分层得到酯;
(3)乙装置中长导管C的作用是冷凝回流甲醇,平衡内外大气压强;冷凝管应从下口进水,上口出水,以保证水充满冷凝管,起到充分冷凝的作用,
故答案为:冷凝回流甲醇,平衡内外大气压强;b;
(4)甲醇是有毒的易挥发的有机物,需要良好的冷凝效果,所以选择乙,因为甲醇有毒,减少大气污染,
故答案为:乙.
点评 本题考查物质的制备,侧重于学生的分析、实验以及计算能力的考查,注意把握有机物反应的特点以及常见仪器的使用,把握实验的原理和操作方法,难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
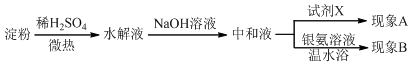
| A. | 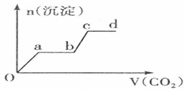 | B. | 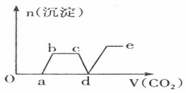 | ||
| C. | 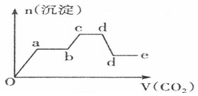 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
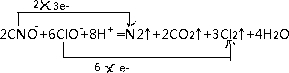 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com