
| A. | 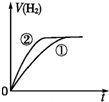 | B. |  | C. | 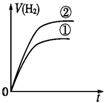 | D. | 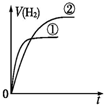 |
分析 相同体积、相同pH的一元强酸和一元中强酸溶液,初始时C(H+)相同,一元中强酸溶液中存在酸的电离平衡,则一元中强酸的浓度大于一元强酸的浓度,与足量的锌粉反应产生的氢气体积大,反应过程中一元中强酸溶液②继续电离,溶液中氢离子浓度大,产生氢气速率快.
解答 解:因为强酸完全电离,一元中强酸部分电离,因此相同的PH值,即C(H+)相同时,一元中强酸的浓度比强酸浓度大,由于体积相等,因此一元中强酸的物质的量大于强酸,因此产生的H2也比强酸多.反应过程由于H+不断被消耗掉,促使一元中强酸继续电离出H+,由于其他条件都相同,反应速率取决于H+浓度,由于开始时H+浓度相等,因此反应速率也相等(在图中反应速率就是斜率),后面强酸的反应速率下降得快,斜率也就更小,曲线更平坦.最终生成H2的体积也比一元中强酸少,因此曲线在一元中强酸下面,故C符合;
故选C.
点评 本题考查了弱电解质溶液的电离平衡移动,题目难度不大,注意一元中强酸属于弱电解质,在溶液中存在电离平衡,侧重于考查学生的分析能力.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气常用于饮用水消毒:Cl2+H2O?HClO+H++Cl- | |
| B. | 用漂白精溶液吸收尾气的SO2:Ca2++ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 铝离子、亚铁离子开始沉淀的pH分别是4.1、7.5,在Al2Fe(SO4)4溶液中滴加少量烧碱溶液产生白色沉淀:Fe2++20H-=Fe(OH)3↓ | |
| D. | 用银为电极电解盐酸:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Fe2+、NO3-、Cl- | B. | Na+、SO42-、Ba2+、H+ | ||
| C. | Na+、CO32-、Cl-、NO3- | D. | Al3+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
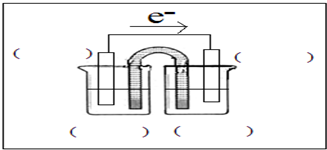 能量之间可以相互转化:原电池可将化学能转化为电能.
能量之间可以相互转化:原电池可将化学能转化为电能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃铝粉可以引发NH4ClO4分解 | |
| B. | NH4ClO4迅速分解时可能会引发爆炸 | |
| C. | NH4ClO4应低温通风保存,远离火种、热源 | |
| D. | 0.5 mol NH4ClO4分解时产生的气体体积是44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 和NaOH | B. | Na2CO3和CaCl2 | C. | NaHCO3和HCl | D. | NaCl和AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO4-、Cl-、Na+ | B. | ClO-、Cl-、H+ | C. | NaClO、NaClO3 | D. | NaClO、NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com