

分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A加稀硫酸使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过过滤、洗涤、干燥,灼烧得到ZnO,
不溶物Fe中加入稀盐酸,反应生成氯化亚铁,加入适量NaClO3,氧化部分亚铁离子为铁离子:流程中加人NaClO3氧化部分亚铁离子为铁离子,发生反应为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,得到含Fe2+、Fe3+的B溶液,再加入NaHCO3,并通入氮气,生成四氧化三铁胶体粒子,据此分析解答.
解答 解:(1)溶液A为Na2ZnO2,加稀H2SO4生成Zn(OH)2,离子方程式为ZnO22-+2H+=Zn(OH)2↓;
故答案为:ZnO22-+2H+=Zn(OH)2↓;
(2)已知:Ksp[Zn(OH)2]=1.2×10-17,Zn(OH)2饱和溶液中c(Zn2+)=3×10-6mol/L,Zn(OH)2开始溶解,则c(Zn2+)•c(OH-)2<Ksp[Zn(OH)2],则c(OH-)<$\sqrt{\frac{1.2×1{0}^{-17}}{3×1{0}^{-6}}}$=2×10-6mol/L,故c(H+)>5×10-9mol/L,故pH为8.3时开始溶解,为防止Zn(OH)2溶解,可将稀H2SO4改为弱酸,故可选择通入CO2气体;
故答案为:8.3;CO2;
(3)流程中加人NaClO3氧化部分亚铁离子为铁离子,发生反应为6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,还原剂与氧化剂反应的物质的量之比是6:1;
故答案为:6:1;
(4)①持续通入N2,防止Fe2+[或Fe(OH)2]被氧化;
故答案为:防止Fe2+[或Fe(OH)2]被空气(或氧气)氧化;
②胶体微粒直径范围为1~100nm;
故答案为:1~100nm;
③亚铁离子能与K3[Fe(CN)6]溶液生成蓝色沉淀,同时具有还原性,可使酸性高锰酸钾溶液褪色;
故答案为:K3[Fe(CN)6]溶液或酸性高锰酸钾溶液;
(5)根据题意:Zn(OH)2既能溶于强酸,又能溶于强碱,还能溶于氨水,生成[Zn(NH3)4]2+,则可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制;
故答案为:可溶性锌盐与氨水反应产生的氢氧化锌要溶于过量的氨水中,生成[Zn(NH3)4]2+,氨水的量不易控制.
点评 本题以物质的制备为载体,考查实验基本操作和技能,对信息的利用、实验条件的控制、溶度积的计算等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力,注意对题目信息的获取.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
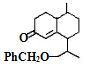
| A. | 属于芳香烃 | B. | 是高分子化合物 | ||
| C. | 可使溴水和酸性高锰酸钾溶液褪色 | D. | 苯环上的一氯取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熟石灰和水 | B. | 生石灰和水 | ||
| C. | 氯化钠和水 | D. | 氯化铵和氢氧化钡晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com