I.工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H
2(g)?CH
3OH(g).
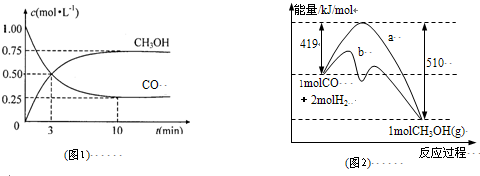
(1)图1是反应时CO和CH
3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
0.075mol?L-1?min-1
0.075mol?L-1?min-1
;
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是
放热
放热
(选填“吸热”或“放热”)反应,写出反应的热化学方程式
CO(g)+2H2(g)═CH3OH(g)△H=-91KJ/mol
CO(g)+2H2(g)═CH3OH(g)△H=-91KJ/mol
;选择适宜的催化剂,
不能
不能
(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表达式为
,温度升高,平衡常数K
减小
减小
(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使
增大的有
c
c
.
a.升高温度; b.充入He气 c.再充入1molCO和2molH
2 d.使用催化剂
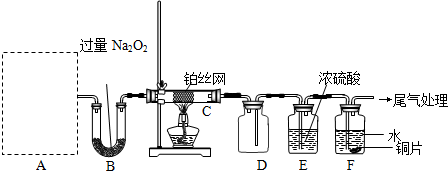
II.(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置.A中所用试剂从下列固体物质中选取:a.NH
4HCO
3、b.NH
4Cl、c.Ca(OH)
2、d.NaOH.
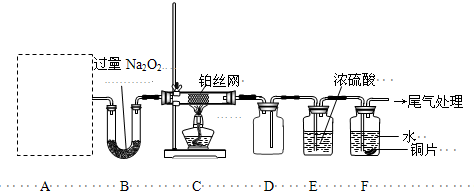
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯.部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解.
(1)实验室制取A中气体时若只用一种试剂,该试剂是
a
a
(填备选试剂的字母);此时A中主要的玻璃仪器有
试管、酒精灯(导管)
试管、酒精灯(导管)
(填名称).
(2)A中产生的物质被B中Na
2O
2充分吸收,写出任意一个B中发生反应的化学方程式:
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2
.
(3)对于C中发生的可逆反应,下列说法正确的是
a
a
.
a.增大一种反应物的浓度可以提高另一种反应物的转化率
b.工业上进行该反应时,可采取高压的条件提高反应物转化率
c.该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
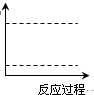
(4)请在图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(5)待实验结束后,将B中固体混合物溶于500mL1mol?L
-1 盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na
2O
2的物质的量是
0.25
0.25
mol,甲在标准状况下是
2.8
2.8
L(忽略气体的溶解).