
分析 (1)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,Cl元素的化合价降低,该反应转移10e-;
(2)氧化还原反应中,化合价升高元素所在反应物是还原剂,对应产物是氧化产物,化合价降低元素所在的反应物是氧化剂,对应产物是还原产物;
(3)根据反应:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,结合高锰酸钾的质量可以计算产生氯气以及消耗盐酸的物质的量,进而计算氯气体积,由反应可知,16molHCl参加反应时,其中10molHCl作还原剂,6mol作酸,则被氧化与未被氧化的HCl的物质的量之比为10mol:6mol=5:3.
解答 解:(1)高锰酸钾和浓盐酸的反应中,Mn得到电子、Cl失去电子,该反应转移10e-,转移电子的表示方法为 ,
,
答:双线桥法标明电子转移的方向和数目为 ;
;
(2)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,则KMnO4为氧化剂,Cl元素的化合价由-1价升高为0,则HCl为还原剂,C12是氧化产物,答:反应中氧化剂、氧化产物分别是:KMnO4、Cl2;
(3)设:15.8gKMnO4的物质的量为:$\frac{15.8g}{158g/mol}$=0.1mol,完全反应,产生Cl2的物质的量是x,同时消耗的HCl的物质的量为y,
2KMnO4+16HCl═2KCl+2MnCl2十5C12↑+8H2O
2 16 5
0.1mol y x
$\frac{2}{0.1}$=$\frac{16}{y}$=$\frac{5}{x}$,解得x=0.25mol,y=0.8mol,产生Cl2的体积是0.25mol×22.4L/mol=5.6L,被氧化与未被氧化的HCl的物质的量之比为10mol:6mol=5:3,被氧化的HCl的物质的量为0.5mol.
答:产生标准状况下Cl2的体积为5.6L,同时被氧化的HCl的物质的量为0.5mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及转移电子、原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
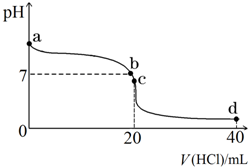 室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.
室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和二氧化硫都能使品红溶液褪色 | |
| B. | 异戊烷和异戊二烯都能使溴水层褪色 | |
| C. | 亚硫酸钠和乙烯都能使酸性高锰酸钾溶液褪色 | |
| D. | 活性炭与氢氧化钠溶液都能使二氧化氮气体褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
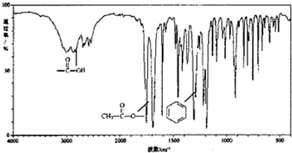 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子; M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示): ,其基态原子有26种运动状态不同的电子;
,其基态原子有26种运动状态不同的电子;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
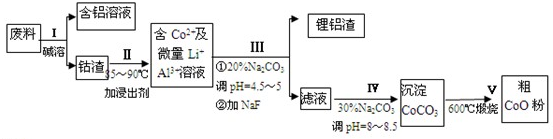
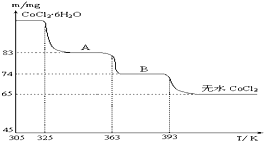
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com