
在0.30 mol NH3中含有NH3的分子数目是________个,这些NH3中所含原子数目与________mol H2S所含原子数目相等.
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:辽宁省沈阳二中2011届高三第四次阶段测试化学试题 题型:058
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如下图.

(1)温度不变,缩小体积,①的逆反应速率________(填“增大”、“减小”或“不变”)
(2)反应①的ΔH1________0(填“<”“=”或“>”)100℃时的平衡常数值K=________.
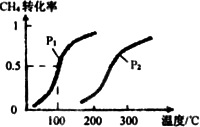
(3)在压强为0.1 Mpa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下进行反应②再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
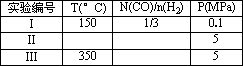
300℃时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是________(填字母)
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH2OH(l)+3O2(g)=2CO2(g)+4H2O(g)ΔH=-1275.6 kJ/mol
②2CO(g)+O2(g)=2CO2(g)ΔH=-556.0 kJ/mol
③H2O(g)=H2O(l)ΔH=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式________.
(5)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置.

①该电池正极的电极反应为________.
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
________.
查看答案和解析>>
科目:高中化学 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
请按要求回答下列问题:
(1)将0.20 mol CH4和0.30 mol H2O(g)通入容积为2 L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如下图.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)________;ΔH1________0,p1________p2(均填“<”、“=”或“>”);p1、100℃时平衡常数的值K=________.
(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.
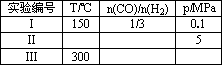
若在300℃时其他条件不变,将该反应容器容积压缩到原来的1/2,重新平衡时CH3OH的物质的量的变化是________,K的变化是________(均填“增大”,“减小”或“不变”).
(3)已知在常温常压下:2CH3OH(I)+3O2(g)![]() 2CO2(g) ΔH=-1275.6 kJ/mol
2CO2(g) ΔH=-1275.6 kJ/mol
H2O(g)=H2O(I) ΔH=-44.0 kJ/mol,请计算32 g新型燃料甲醇完全燃烧生成液态水放出热量为________kJ.
(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如下图所示,电池工作时电子移动方向是(极板用M、N表示)________,负极电极反应式为________.
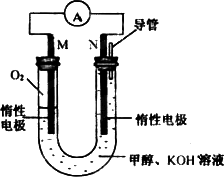
若以该燃料电池作为电源,用石墨作电极电解500 mL饱和食盐水,当两极共收集到1.12 L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=________(假设反应前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源:2013学年海南省琼海市嘉积中学高二下学期教学质量监测(二)文科化学卷(带解析) 题型:单选题
在N2+3H2  2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol/L,在此时间内用NH3表示的反应速率为0.30 mol/(L·s)。则此一段时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6 mol/L,在此时间内用NH3表示的反应速率为0.30 mol/(L·s)。则此一段时间是( )
| A.1秒 | B.2秒 | C.0.44秒 | D.1.33秒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com