
| 化学式 | Fe(OH)2 | Fe(OH)3 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.8x10-11 |
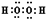
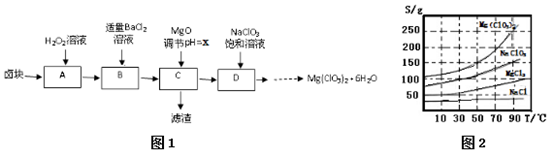
分析 卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质,
(1)过氧化氢为共价化合物,氢原子与氧原子之间形成共用电子对;
(2)氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,MgO的作用是调节溶液的pH,使杂质Fe3+形成沉淀完全除去.根据示意图可知滤渣的主要成分为BaSO4和Fe(OH)3;
(3)根据氢氧化铁的Ksp计算溶液的氢氧根离子浓度,由此计算pH;
(4)氯酸钠饱和溶液与氯化镁生成氯化钠;利用NaCl、Mg(ClO3)2的溶解度与温度的关系,将溶液蒸发浓缩结晶、趁热过滤、冷却结晶,最后过滤、洗涤,得到Mg(ClO3)2•6H2O;
(5)①Cr2O72-能将Fe2+氧化成Fe3+,根据电子得失守恒可写离子方程式;
②若K2Cr2O7标准溶液时未润洗滴定管,则标准液浓度偏小,用去的标准液体积偏大,据此分析;
③根据化学反应ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,根据各个质物之间的关系式可计算百分含量.
解答 解:(1)H2O2的电子式为: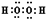 ;
;
故答案为: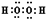 ;
;
(2)氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,滤渣的主要成分为BaSO4和Fe(OH)3;
故答案为:Fe(OH)3、BaSO4;
(3)已知Fe(OH)3的Ksp为8.0×10-38,铁离子的浓度为1×10-5 mol/L,则c(OH-)=$\root{3}{\frac{8.0×1{0}^{-38}}{1×1{0}^{-5}}}$mol/L=2×10-11mol/L,故c(H+)=5×10-4mol/L,故pH=3.3;
故答案为:3.3;
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl↓,根据物质的溶解度大小,溶液获得Mg(ClO3)2•6H2O晶体的方法:蒸发结晶、过滤、冷却结晶,
故答案为:MgCl2+2NaClO3=Mg(ClO3)2+2NaCl↓;趁热过滤;
(5)①Cr2O72-能将Fe2+氧化成Fe3+,反应的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
故答案为:Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O;
②若K2Cr2O7标准溶液时未润洗滴定管,则标准液浓度偏小,用去的标准液体积偏大,计算得的与K2Cr2O7标准溶液反应的Fe2+的物质的量偏大,所以与Mg(ClO3)2反应的Fe2+的物质的量偏小,所以会导致计算出的产品中Mg(ClO3)2•6H2O的含量会偏小;
故答案为:偏小;
③根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×$\frac{1}{6}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%;
故答案为:78.3%.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,是对学生综合能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 96g | B. | 74g | C. | 82.5g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并探究固体产物成分(图中夹持及尾气处理装置均已略去).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
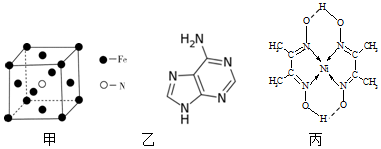
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
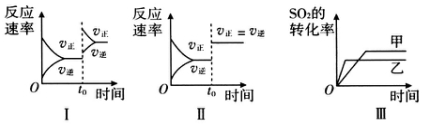
| A. | 图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响 | |
| B. | 图Ⅱ研究的是t0时刻通入氦气增大体系压强对反应速率的影响 | |
| C. | 图Ⅱ研究的是t0时刻加入催化剂对化学平衡的影响 | |
| D. | 图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明“84”消毒液的氧化能力随溶液pH的减小而增强 | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 |
| B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL1mol•L-1CuSO4溶液,迅速产生较多气泡 |
| C | 检验淀粉是否水解 | 在试管中取少量淀粉,加入稀硫酸后加热片刻,冷却后取澄清液滴入新制的Cu(OH)2加热沸腾 |
| D | 证明SO2有漂白性 | 将SO2通入酸性高锰酸钾溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com