
| A.检验某溶液中是否含有K+ | B.除去CO中的CO2 | C.实验室制取氯气 | D.加热分解NaHCO3固体 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
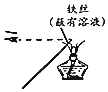
分析 A.观察钾离子的火焰颜色时需要通过蓝色钴玻璃;
B.二氧化碳与氢氧化钠溶液反应,而CO不反应;
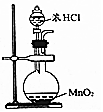
C.在加热条件下二氧化锰才能与浓盐酸反应生成氯气;
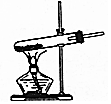
D.碳酸氢钠分解生成水,大试管口应该稍稍向下倾斜.
解答 解:A.通过焰色反应判断是否含有钾离子时,需要通过蓝色钴玻璃观察以便滤去钠的黄色,图示操作方法不合理,无法达到实验目的,故A错误;
B.CO不与氢氧化钠溶液反应,用氢氧化钠溶液可以除去CO中混有的二氧化碳气体,故B正确;
C.图示装置制取氯气时,需要用酒精灯加热,图示装置没有加热装置,无法达到实验目的,故C错误;
D.该反应中有水生成,为了避免大试管炸裂,装置中大试管口应该稍稍向下倾斜,图示装置不合理,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度中等,涉及离子检验、物质分离与提纯、气体制备原理等知识,明确常见化学实验基本操作方法为解答关键,试题有利于提高学生的化学实验能力.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2气体中含有的少量杂质SO2可通过饱和Na2CO3溶液除去 | |
| B. | NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去 | |
| C. | K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯 | |
| D. | Cu粉中含有的少量杂质Fe可加入FeCl3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含lmolFeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | 正确:Cl2过量,可将Fe2+、I-均氧化 |
| B | 稀硝酸中加过量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 正确:过量的Fe还原了Fe3+ |
| C | 过量SO2通入到NaClO 溶液中:ClO-+SO2+H2O═HSO3-+HClO | 正确:说明酸性:H2SO3强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH 溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O+CO32- | 正确:酸式盐与碱反应生成正盐和水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| B. | 金属钠存放于煤油中 | |
| C. | 浓硝酸保存在棕色试剂瓶中 | |
| D. | 漂白粉长期敞口放置在烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cu与足量稀硝酸反应产生NA个NO分子 | |
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L-1 | |
| C. | 通常条件下,7.1g 37Cl2含中子数为4.0NA | |
| D. | 2.4g Mg在足量O2中燃烧,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基的结构式: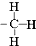 | B. | 硝基苯的结构简式: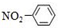 | ||
| C. | 氯乙烷的分子式:C2H5Cl | D. | 丙烷分子的球棍模型示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.1mol二氧化硅中所含硅氧键数目为0.2NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 常温常压下,46gNO2含有原子数为3 NA(相对原子质量N:14 O:16) | |
| D. | 标准状况下,11.2LSO3含有分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com