
 +Br2→
+Br2→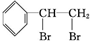 ,反应类型是加成反应.
,反应类型是加成反应. 分析 (1)根据相对分子质量和含碳量可计算含氢量,进而计算C、H原子数目,可知分子式;
(2)该物质含有苯环,能与溴发生反应,说明A应为苯乙烯.
解答 解:(1)1molA中含有C、H的物质的量为:n(C)=$\frac{104g×92.3%}{12g/mol}$=8mol、n(H)=$\frac{104g×(1-92.3%)}{1g/mol}$=8mol,则化合物A的分子式为:C8H8,
故答案为:C8H8;
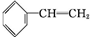
(2)该物质含有苯环,能与溴发生反应,说明A应为苯乙烯,结构为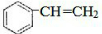 ,与溴发生加成反应生成
,与溴发生加成反应生成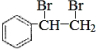 ,则反应的方程式为
,则反应的方程式为 +Br2→
+Br2→ ,
,
故答案为: +Br2→
+Br2→ ;加成反应.
;加成反应.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为的解答关键,注意掌握守恒思想在确定有机物分子式中的应用,试题培养了学生的化学计算能力.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:多选题
| A. | 酸式滴定管未用标准盐酸润洗,直接装入标准盐酸 | |
| B. | 酸式滴定管滴定前有气泡,滴定后气泡消失 | |
| C. | 滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥 | |
| D. | 读取醋酸体积时,开始仰视读数,滴定结束后俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的最高正化合价+6 | |
| B. | 简单离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的稳定性:Q>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水 | B. | NaNO3溶液 | C. | NaCl溶液 | D. | CuSO4粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
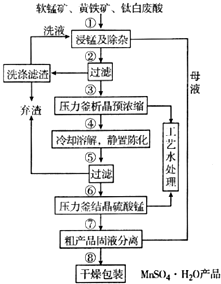 随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题:
随着科学技术的不断进步,锰的用量和应用领域不断扩大.硫酸锰作为基础锰盐,研究、开发生产硫酸锰的新工艺,尤其必要.现代工业常以软锰矿(主要成分为MnO2,杂质为铁和铜的化合物等)为原料通过“浸锰”操作制备高纯硫酸锰,工艺流程示意图如图所示,请回答下列问题: (3)经查阅资料,生成相应氢氧化物时的pH如表所示.
(3)经查阅资料,生成相应氢氧化物时的pH如表所示.| 化学式 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CDEAB | B. | ECDAB | C. | BAEDC | D. | BADCE |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
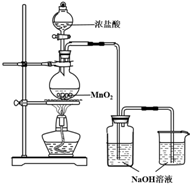 某实验小组用如图装置制备家用消毒液,并探究其性质.
某实验小组用如图装置制备家用消毒液,并探究其性质.| 操作 | 现象 |
| A.测溶液pH,并向其中滴加2滴酚酞 | pH=13,溶液变红,5min后褪色 |
| B. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
| 操作 | 现象 |
| 取5ml,pH=13NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com