
| A. | 已溶解的溶质和未溶解的溶质质量相等 | |
| B. | 溶解和结晶均停止,溶质达到溶解平衡状态 | |
| C. | 升高温度,饱和溶液将变为不饱和溶液 | |
| D. | 溶质的溶解和结晶继续进行,且速率相等 |
分析 A.对于饱和溶液而言,已溶解的溶质和未溶解的溶质质量相对大小不定;
B.饱和溶液处于溶解沉淀平衡状态,是一个动态平衡;
C.对于溶解度随温度升高而减小的物质而言,升高温度,饱和溶液仍是饱和溶液;
D.饱和溶液处于溶解沉淀平衡状态,正逆反应速率相等.
解答 解:A.对于饱和溶液而言,已溶解的溶质和未溶解的溶质质量大小不能确定,故A错误;
B.饱和溶液处于溶解沉淀平衡状态,溶质溶解并没有停止,故B错误;
C.对于溶解度随温度升高而减小的物质而言,升高温度,饱和溶液仍是饱和溶液,故C错误;
D.饱和溶液处于溶解沉淀平衡状态,溶质的溶解和结晶继续进行,且速率相等,故D正确;
故选D.
点评 本题考查了饱和溶液,题目难度不大,注意饱和溶液处于溶解沉淀平衡状态,是一个动态平衡,正逆反应速率相等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯、溴水、铁粉混合制成溴苯 | |
| B. | 加浓溴水,然后过滤可除去苯中少量苯酚 | |
| C. | 用高锰酸钾酸性溶液来区别甲烷和乙烯 | |
| D. | 可用分液漏斗分离乙醇和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌、铜电极和稀硫酸溶液构成的原电池中铜是正极 | |
| B. | 在镀件上镀铜时可用金属铜作阳极 | |
| C. | 用电解法精炼粗铜时粗铜发生氧化反应 | |
| D. | 用电解法精炼粗铜时纯铜作阳极 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟二化学试卷(解析版) 题型:选择题
下列对实验现象的解释与结论均正确的是( )
选项 | 实验操作 | 实验现象 | 解释与结论 |
A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42﹣ |
B | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加少量稀NaI溶液 | 开始有白色沉淀生成,后有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
C | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
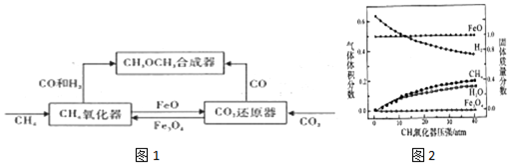
| 温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
| CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
| CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②⑤ | C. | ①②④ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com