
【题目】物质结构决定物质性质,回答下列涉及物质结构和性质的问题。
(1)笫二周期中,元素的第一电离能处于B与N之间的元素有______ 种。
(2)某元素位于第四周期VII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为___________。
(3)AlC13是有机合成和石油化工的催化剂,已知AlCl3可以通过配位键形成具有桥式结构的双聚分子Al2Cl6,Al2Cl6分子的结构式为_________。
(4)KCN可被H2O2氧化为KOCN。KOCN可作为制药材料,其晶体类型是________,碳原子采取sp杂化,1mol该物质中含有的π键数目为______;H2O2常温下是液体,沸点较高(150℃),其主要原因是____________。
(5)氮化硼(BN)和磷化硼(BP)都是受到高度关注的耐磨涂料,它们结构相似,但是氮化硼晶体的熔点要比磷化硼晶体高,其原因是________。
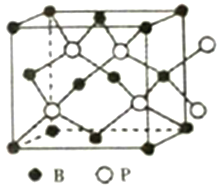
(6)磷化硼晶体的晶胞结构如图所示,在BP晶胞中B原子的堆积方式为______,若图中立方体的边长为a pm,则磷化硼中硼原子和磷原子之间的最近距离为__________。
【答案】 3 3d84s2 ![]() 或
或![]() 离子晶体 2NA 分子间存在氢键 由于二者形成的晶体都是原子晶体,而磷原子的半径比氮原子大,N—B共价键键长比B——P小,N—B共价键键能大,因此氮化硼晶体的熔点要比磷化硼晶体高。 面心立方堆积
离子晶体 2NA 分子间存在氢键 由于二者形成的晶体都是原子晶体,而磷原子的半径比氮原子大,N—B共价键键长比B——P小,N—B共价键键能大,因此氮化硼晶体的熔点要比磷化硼晶体高。 面心立方堆积 ![]() 或
或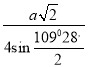
【解析】(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2;
(3)Cl原子最外层有7个电子,只能与Al原子各提供1个电子形成一个共价键,使自己达到8电子稳定结构.Al原子最外层有3个电子,可分别与3个Cl原子形成共价键,因而Cl原子与2个Al原子形成的化学键中,必有1个是配位键,由于电子对由Cl原子提供,这样Cl原子最外层电子数仍为8,Al原子最外层也成为8电子结构,则Al2Cl6分子的结构式为![]() 或
或![]() ;(4) KOCN是由活泼金属和非金属构成的属于离子晶体,C能形成的4个共价键,已知其杂化方式为sp杂化,说明含有2个δ键即有2个价层电子对,另外的2个共价键为π键,所以1mol该物质中含有的π键数目为2NA;②H2O2分子之间存在氢键,使其沸点较高;
;(4) KOCN是由活泼金属和非金属构成的属于离子晶体,C能形成的4个共价键,已知其杂化方式为sp杂化,说明含有2个δ键即有2个价层电子对,另外的2个共价键为π键,所以1mol该物质中含有的π键数目为2NA;②H2O2分子之间存在氢键,使其沸点较高;
(5)原子晶体中,物质熔点与原子半径、键长成反比,磷原子的半径比氮原子大,N-B共价键键长比B-P小,键能大,所以氮化硼晶体的熔点要比磷化硼晶体高;
(6)由晶胞结构可知,B原子处于晶胞顶点与面心,在BP晶胞中B的堆积方式为面心立方最密堆积,P原子与周围的4个B原子最近且形成正四面体结构,二者连线处于体对角线上,为体对角线的![]() ,立方体的每条边长为a pm,则晶胞体对角线长为
,立方体的每条边长为a pm,则晶胞体对角线长为![]() apm,则P原子与B原子最近距离为
apm,则P原子与B原子最近距离为![]() apm×
apm×![]() =
=![]() pm。
pm。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)![]() CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等体积的两容器内分别充满由![]() N、l3C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
N、l3C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A. 所含分子数和质量均不相同 B. 含有相同的分子数和电子数
C. 含有相同的质子数和中子数 D. 含有相同数目的中子、原子和分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质反应产物与物质的浓度有关的是( )
①铜与硝酸溶液 ②铜与氯化铁溶液 ③锌与硫酸溶液 ④铁与盐酸溶液
A. ①③ B. ③④ C. ①② D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断不正确的是
A. 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B. 实验①中,用160 mL10 mol/L的浓盐酸与足量KMnO4充分反应,标准状况下可制得11.2 L的Cl2
C. 实验①生成的气体能使湿润的淀粉KI试纸变蓝
D. 实验①中要收集纯净干燥的黄绿色气体,应将气体依次通过饱和食盐水和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯在催化剂存在下与液溴反应,而苯酚与溴水反应不用加热也不需催化剂,原因是( )
A. 苯环与羟基相互影响,使苯环上氢原子活泼
B. 苯环与羟基相互影响,使羟基上氢原子变活泼
C. 羟基影响了苯环,使苯环上的氢原子变活泼
D. 苯环影响羟基,使羟基上的氢原子变活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是:
A. 漂白粉被氧化了
B. 漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C. 有色布条被空气中的氧气氧化
D. 漂白粉溶液失去了部分水分,浓度增大了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海洋资源可以获得很多物质。如从海水中可以得到食盐等许多化工原料,可以通过蒸馏获得淡水,从海洋植物中提取碘等。
(一)从海水得到的粗盐中常含有杂质需要分离提纯,在除去悬浮物和泥沙之后,要用以下试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、 Mg2+、SO42-。
(1)为有效除去Ca2+、 Mg2+、SO42-,加入试剂的合理顺序为___________。
a.先加 NaOH,后加Na2CO3,再加 BaCl2
b.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(2)加入Na2CO3过程中发生反应的离子方程式为_______________________。
(3)判断试剂BaCl2己经足量的方法是_______________________。
(二)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下:
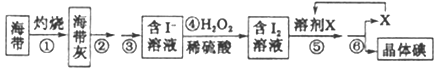
(1)实验时灼烧海带应在___________(填仪器名称)内进行。
(2)步骤④中反应的离子方程式是_______________。
(3)步骤⑤的实验操作为____________,应选用的一种溶剂X可以是____________。
a.苯、酒精 b.四氯化碳、苯 c.汽油、酒精
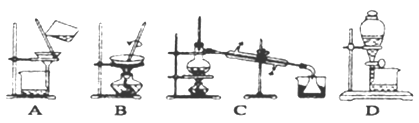
(4)步骤⑥的实验操作应选用下图中的_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相对分子质量为70的烯烃的分子式为_____________;若该烯烃与足量的H2加成后能生
成含3个甲基的烷烃,写出该烯烃一种可能的结构简式_______________;并对其用系统命名法命名________。
(2)有机物A的结构简式为
①若A在光照条件下与氯气发生取代反应,则生成的一氯代物可能有________种结构;
②A是炔烃与氢气加成后的产物,则此炔烃可能有________种结构。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com