
| A. | N2+O2═2NO | B. | N2+3H2═2NH3 | ||
| C. | 2NO+O2═2NO2 | D. | 3NO2+H2O═2HNO3+NO↑ |
分析 在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮气体;一氧化氮不溶于水,在常温下易跟空气中的氧气化合,生成红棕色的二氧化氮气体;二氧化氮易溶于水,它溶于水后生成硝酸和一氧化氮,据此分析解答.
解答 解:“雷雨发庄稼”,空气中的N2在放电条件下与O2直接化合生成无色且不溶于水的一氧化氮气体,N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
一氧化氮的密度比空气略大,不稳定,常温下就易与空气中的O2反应生成红棕色的二氧化氮气体,2NO+O2=2NO2;
二氧化氮气体有毒,易与水反应生成硝酸(HN03)和一氧化氮,3NO2+H2O=2HNO3+NO;
生成的硝酸随雨水淋洒到大地上,同土壤中的矿物相互作用,生成可溶于水的硝酸盐可作氮肥,植物生长得更好,不包括选项中氮气和氢气合成氨的反应,
故选B.
点评 本题主要考查了雷雨肥田原理,氮气、一氧化氮、二氧化氮的化学性质,理解反应原理、正确书写化学方程式是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1mol•L-1 | |
| B. | b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | c点所示溶液中:c(Na+)<3c(R2-) | |
| D. | d点所示溶液中:c(Na+)>c(R2-)>c(HR-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
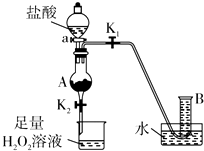 氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):
氯化铁是实验室中的重要试剂.某同学用m g含有铁锈(Fe2O3)的废铁屑来制取FeCl3•6H2O晶体,同时测定废铁屑中铁的质量分数,为此设计了如图装置(夹持装置略,气密性已检验):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入溴水中,测定反应前后溶液pH,pH增大,乙烯与溴发生取代反应 | |
| B. | 向某溶液中加入KSCN溶液和稀盐酸,溶液变红色,原溶液一定有Fe3+ | |
| C. | 将湿润的氨气通过无水CaCl2,可得到干燥的氨气 | |
| D. | 分别取一块小木条,放入饱和硅酸钠溶液和蒸馏水中,充分吸湿、浸透,取出稍沥干后,置于酒精灯外焰处,前者木条未燃烧,后者燃烧,可证明硅酸钠可作木材防火剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化反应 | B. | 加成反应 | C. | 加聚反应 | D. | 酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
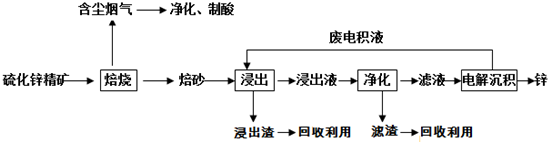
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: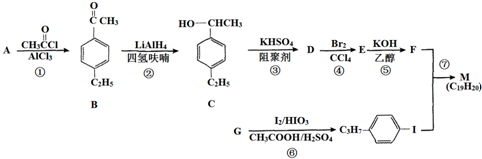
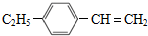 ,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;
,分子中最多有10个碳原子共平面,F结构中的官能团名称是碳碳三键;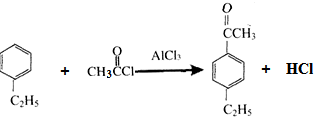 ,④的反应类型是加成反应;
,④的反应类型是加成反应;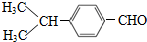 (写结构简式);
(写结构简式);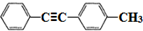 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
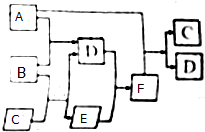 有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E六种微粒,其中A-E五种微粒均由两元素组成且均含10个电子,它们有如图所示的转化关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com