
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
分析 根据质量守恒定律,由物质质量的增减可确定反应物和生成物;由增减量的多少克确定反应物和生成物的质量关系,再结合甲、丁的相对分子质量关系得出本题答案.
解答 解:根据质量守恒定律,由表中乙,丙质量增加,可确定乙,丙为生成物,共增加了(21-10)g+(10-1)g=20g,
丁减少了(25-9)g=16g,减少的质量还差(20-16)g=4g,由此可知4g甲完全反应物剩余,即甲、丁反应的质量比为4g:16g=1:4,
设该反应的化学方程式中甲与丁的化学计量数的比为m:n,又丁的相对分子质量是甲的2倍,则m:2n=1:4,解得m:n=1:2,
故选B.
点评 本题主要考查质量守恒定律,通过反应中物质的质量变化确定了反应物和生成物,再结合物质的相对分子质量关系,得出反应中物质的化学计量数之比,本题难度中等.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:选择题
| A. | 同分异构现象只存在于有机物和无机物之间 | |
| B. | 同分异构现象不存在于无机物之间 | |
| C. | 在无机化合物和有机化合物间一定存在同分异构现象 | |
| D. | 在无机化合物和有机化合物间可能存在同分异构现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 11种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2中含有的分子数为2×6.02×1023 | |
| B. | 用激光笔照射CuSO4溶液可产生“丁达尔效应” | |
| C. | 常温下,铝片能溶于浓硫酸 | |
| D. | 常温下,淀粉溶液遇I2变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
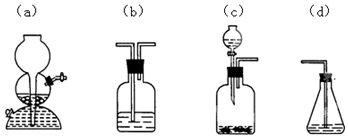
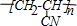 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
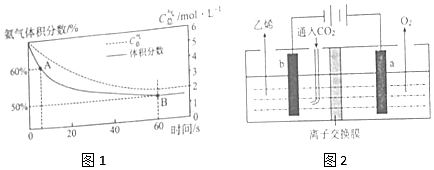
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰化钾中含有离子键和极性键 | |
| B. | 氰化钾中碳元素的化合价为+4价 | |
| C. | KCN与KMnO4溶液反应可能生成CO2和N2 | |
| D. | 相同条件下,KCN溶液的碱性强于CH3COOK溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com