

| n(CO):n(H2O) | CO转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
| 生成物平衡浓度幂之积 |
| 反应物平衡浓度幂之积 |
| △n |
| n |
| 1 |
| 2 |
| 1 |
| 2 |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| 生成物浓度的幂之积 |
| 反应物浓度的幂之积 |
| C(CO2)?C(H2) |
| C(CO)?C(H2O) |
| △n |
| n |
| 生成物平衡浓度幂之积 |
| 反应物平衡浓度幂之积 |
| Xmol/L × Xmol/L |
| (1-X)mol/L × (4-X)mol/L |
| 0.8mo/L |
| 1mol/L |


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (4)
(4) (5)CH3Cl
(5)CH3Cl  (7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3
(7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、.萃取、分液、蒸馏 |
| B、分液、萃取、蒸馏 |
| C、萃取、蒸馏、分液 |
| D、蒸馏、分液、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
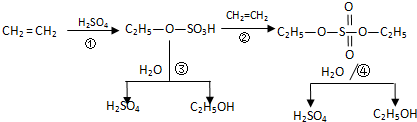
| A、该过程中③、④是酯类的水解反应 |
| B、该过程中硫酸是催化剂 |
| C、该过程中①、②是加成反应 |
| D、该过程是一种新的硫酸生产方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com