
【题目】在两个密闭容器中,分别装有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且乙的密度大于甲的密度,下列说法正确的( )
A. 甲的分子数比乙的分子数多 B. 甲的摩尔体积比乙的摩尔体积小
C. 甲的物质的量比乙的物质的量少 D. 甲的相对分子质量比乙的相对分子质量大
【答案】A
【解析】
两容器的温度和压强均相同,则气体的Vm相等,两容器气体质量相等,且乙的密度大于甲的密度,可以知道乙体积小于甲体积,由n=![]() 可以知道乙气体的物质的量小于甲,以此解答该题。
可以知道乙气体的物质的量小于甲,以此解答该题。
两容器的温度和压强均相同,则气体的Vm相等,两容器气体质量相等,且乙的密度大于甲的密度,可以知道乙体积小于甲体积,由n=![]() 可以知道乙气体的物质的量小于甲,
可以知道乙气体的物质的量小于甲,
A.由以上分析可以知道乙气体的物质的量小于甲,则甲的分子数大于乙的分子数,故A正确;
B. 两容器的温度和压强均相同,则气体的Vm相等,故B错误;
C.由以上分析可以知道乙气体的物质的量小于甲,故C错误;
D.气体质量相同,甲的物质的量比乙的物质的量大,由M=![]() 可以知道乙的相对分子质量大于甲的相对分子质量,故D错误。
可以知道乙的相对分子质量大于甲的相对分子质量,故D错误。
所以A选项是正确的。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 己烷可以使溴水褪色,说明己烷与溴水能发生化学变化
B. 乙醇沸点比丙烷高,因为乙醇形成了分子间氢键
C. 苯不能使酸性高锰酸钾溶液褪色,说明它是一种饱和烃,很稳定
D. 苯酚粘在皮肤上可用氢氧化钠溶液清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下HF的电离常数Ka=4×10-4 ,CaF2的溶度积常数Ksp=1.46×10-10。在该温度下取浓度为0.25 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是
A. 该温度下,0.25 mol·L-1的HF溶液的pH=2
B. 升高温度或增大浓度,HF的电离平衡常数都将增大
C. 两溶液混合不会产生沉淀
D. 向饱和的CaF2溶液中加入少量CaCl2固体后,溶度积常数Ksp一定比之前减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
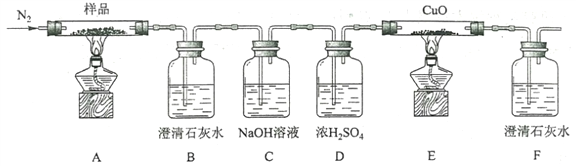
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学用语:
(1)H2S在溶液中的电离方程式:____________________________________________________。
(2)用离子方程式解释NaClO溶液显碱性的原因:_______________________________________。
(3)铬原子的外围电子排布式:________________________。
(4)画出HF分子间的氢键:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.2 mol/L 的BaCl2溶液中含有的Cl-数目为0.4NA
B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积约为 0.224 L
C. 常温常压下,17 g H2O2中所含分子总数为 0.5NA
D. 标准状况下,每转移1 mol电子,消耗1 mol H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入0.lmolSi及0.3molHCl,加热发生反应:![]() 测得SiHCl3的平衡产率与温度及压强的关系如下图所示:
测得SiHCl3的平衡产率与温度及压强的关系如下图所示:

下列说法正确的是
A. 图中P1<P2
B. M点HC1的转化率为10%
C. 平衡时,容器中再加入少量单质Si,HCl的转化率增大
D. 向恒压容器中加入0.2molSi、0.6molHCl,500K、压强为P1时,SiHCl3的平衡产率等于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去下列物质中所含的杂质,所选用的试剂或操作方法错误的是( )
序号 | 物质 | 杂质 | 试剂或方法 |
A |
|
| 加热至恒重 |
B |
|
| 通入过量二氧化碳 |
C |
|
| 加入过量铜粉并过滤 |
D |
|
| 通入氯气 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com