
| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
分析 外围电子排布为3d104s1的元素,根据4s可以判断该元素位于第4周期,再根据外围电子总数为11可知该元素位于周期表从左向右第11列,据此判断该元素为铜,据此分析.
解答 解:根据外围电子排布3d104s1可知,该元素最外层为4s,则位于周期表中第4周期,该元素外围电子总数为11,则该元素位于周期表从左向右第11列,其中ⅤⅢ为8、9、10纵行,则该元素位于周期表ⅠB族,该元素为铜,原子序数为29,能形成稳定的R2+离子,化学反应中,首先失去4s上的电子,所以ACD错误,B正确;
故选B.
点评 本题考查了原子核外电子排布及元素周期表结构,题目难度不大,熟练掌握元素周期表结构为解答关键,注意明确原子核外电子排布式的书写方法,试题侧重基础知识的考查,培养了学生灵活应用所学知识的能力.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 加水,使溶液体积变为原来的10倍 | B. | 升高温度(不考虑NH3的挥发) | ||
| C. | 加入适量的NH4Cl固体 | D. | 加入等体积0.2mol/L的氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 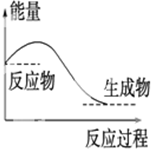 对于如图所示的过程,是放出能量的过程 | |
| B. | 由“C(石墨)=C(金刚石)”反应为吸热,可知,金刚石比石墨稳定 | |
| C. | 由水变成冰是放热反应 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
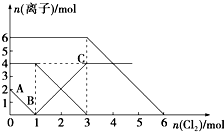 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为6 mol | |
| C. | 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、AlO${\;}_{2}^{-}$、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO${\;}_{4}^{2-}$、S2-、SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
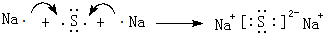 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com