
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届河南省高二第二次月考化学试卷(解析版) 题型:选择题
已知在等温等压条件下,化学反应方向的判据为:
△H-T△S<0 反应能正向自发进行
△H-T△S=0 反应达到平衡状态
△H-T△S>0 反应不能自发进行
设反应A(s)  C(g)
+D(g) △H-T△S=(-4500+11T) J/mol,要防止反应发生,温度必须:
C(g)
+D(g) △H-T△S=(-4500+11T) J/mol,要防止反应发生,温度必须:
A.高于409K B.低于136 K
C.高于136K而低于409K D.低于409K
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省鹤壁高中高二第二次月考化学试卷(带解析) 题型:单选题
已知在等温等压条件下,化学反应方向的判据为:
△H-T△S<0 反应能正向自发进行
△H-T△S=0 反应达到平衡状态
△H-T△S>0 反应不能自发进行
设反应A(s) 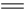 C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:
C(g) +D(g) △H-T△S="(-4500+11T)" J/mol,要防止反应发生,温度必须:
| A.高于409K | B.低于136 K |
| C.高于136K而低于409K | D.低于409K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com