
����Ŀ��ijͬѧ����������ȡ������������Ҫ�ɷ�ΪFe2O3��SiO2��Al2O3��������������������ȡ�̷���FeSO4��7H2O��,��Ƶ�������ͼ��ʾ��

��1������1����Ҫ�ɷ�Ϊ_________���ѧʽ����ͬ�����Լ�X���ѡ��_________��
��2�����д�ʩ�����������ȡ���ʵ���_________ ������ĸ����
A.���������� B.��ϡ���ỻΪ98% ��Ũ����
C.�ʵ��ӿ�������� D.�ʵ������¶�
��3������e��ʵ�����������Ũ����_______��________��ϴ�ӡ����
��4��ijС��ͬѧ������KMnO4��Һ�ζ��̷���Ʒ��ˮ��Һ,���ⶨ�̷���Ʒ����Ԫ�ص�����������
�ٸ�ʵ��ԭ�������ӷ���ʽ�ɱ�ʾΪ________________��
��ȡmg���̷���Ʒ����0.1mol/L ��KMnO4��Һ���еζ�,�ڴ�ʵ������й���ȥ100 mL KMnO4��Һ,����̷���Ʒ����Ԫ�ص���������Ϊ________��
���𰸡� SiO2 Fe ACD ��ȴ�ᾧ ���� 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O ![]()
���������������������������������ȡ����������ȡ�̷�Ϊ���壬�������̵ķ�������������Ի�ѧ��Ӧ���ʵ�Ӱ������ѧʵ��Ļ�������������������Ԫ�����������IJⶨ�������м���ϡ��������ķ�ӦΪ��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��Al2O3+3H2SO4=Al2��SO4��3+3H2O��SiO2�������������SiO2��ϡ�����Ӧ�������1����Ҫ�ɷ�ΪSiO2����Һ1�к���Fe2��SO4��3��Al2��SO4��3���Թ�����H2SO4������Һ1�м�������NaOH��Һ��Fe2��SO4��3ת��ΪFe��OH��3������Al2��SO4��3��H2SO4ת��ΪNaAlO2��Na2SO4�������2�ijɷ�ΪFe��OH��3��Fe��OH��3��ϡ�����ܽ�õ�����Һ3ΪFe2��SO4��3��Һ����Һ3�м����Լ�X�õ�FeSO4��Һ��Ϊ�˲����������ʣ��Լ�X�����Fe��
��1��������������������1����Ҫ�ɷ�ΪSiO2���Լ�X���ѡ��Fe��
��2��A�����������������Ӵ�����������������ȡ���ʣ�B�98%��Ũ������ˮ�����٣�H+��Ũ�Ⱥ�С���������������ȡ���ʣ�C��ʵ��ӿ�������ʣ������������ȡ���ʣ�D��ʵ������¶ȣ������������ȡ���ʣ���ѡACD��
��3������eΪ��FeSO4��Һ�л��FeSO4��7H2O��ʵ�����������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
��4��������KMnO4��Һ����ǿ�����ԣ�Fe2+���л�ԭ�ԣ�����Fe2+������KMnO4��Һ������Fe3+��KMnO4����ԭ��Mn2+����Ӧ�����ӷ���ʽΪ��5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O��
��n��KMnO4��=0.1mol/L![]() 0.1L=0.01mol����n��Fe2+��=5n��KMnO4��=0.05mol����Ԫ�ص�����m=0.05mol
0.1L=0.01mol����n��Fe2+��=5n��KMnO4��=0.05mol����Ԫ�ص�����m=0.05mol![]() 56g/mol=2.8g���̷���Ʒ����Ԫ�ص���������Ϊ
56g/mol=2.8g���̷���Ʒ����Ԫ�ص���������Ϊ![]() 100%��
100%��


 �������¿��ÿ�ʱ��ҵϵ�д�
�������¿��ÿ�ʱ��ҵϵ�д� Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
Ӣ�żƻ�ͬ����ʱ��Чѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
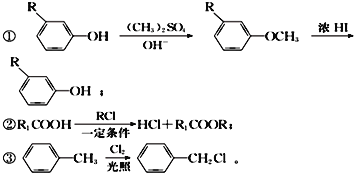
����Ŀ����ͼ�ǹ�ҵ�����л���A��EΪ����ԭ���Ʊ��л���M��һ�ֺϳ�·�ߣ�A����Na2CO3��Һ����ˮ��Ӧ����1molA������2molBr2��Ӧ��B�ı����������ֲ�ͬ��ѧ��������ԭ�ӣ�E��F���Ƿ�������M��һ�־�������������������

��֪��
�ܷ��ǻ��ױ��������������Һ��Ũ���������
�ش��������⣺
��1����F��ͬϵ���У���Է���������С��������______�������ƣ���C�к��������ŵ�����Ϊ____________��
��2��A�Ľṹ��ʽΪ___________��E��F�ķ�Ӧ����Ϊ________��
��3��D+G��M�Ļ�ѧ����ʽΪ_____________________________��
��4��C��ͬ���칹������ͬʱ�������������Ĺ���______�֣����������칹����
����FeCl3��Һ������ɫ��Ӧ ���ܷ���ˮ�ⷴӦ
���к˴Ź���������ʾΪ5��壬�ҷ������Ϊ2��2��2��1��1����_____��д�ṹ��ʽ����
��5�������л���M�������ϳ�·�ߣ����һ����![]() ��(CH3)3CClΪ��ʼԭ���Ʊ�
��(CH3)3CClΪ��ʼԭ���Ʊ�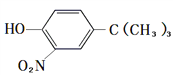 �ĺϳ�·����___________________________��
�ĺϳ�·����___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش���������
��1����ͬ������CO��CO2�����ʵ���֮��Ϊ �� �����ĵ��Ӹ���֮��Ϊ �� �ڱ�״���µ����֮��Ϊ ��
��2��19gij���۽����Ȼ��ACl2���к���0.4mol Cl�� �� ��A����Է���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��X��Ϊ��ѧ��ѧ�������ʣ��ת����ϵ��ͼ��ʾ(����������ȥ)��

I.��AΪ���嵥�ʣ�����B��ʹʪ���ɫʯ����ֽ������EΪ����ɫ���塣
��1��A������Ԫ�������ڱ��е�λ����__________________
��2��ʵ������ȡB�Ļ�ѧ����ʽΪ_________________________________________
��3��D��CO��������β������Ҫ�ɷ֣�ͨ������β����ת��װ����������Ⱦ���壬������Ⱦ���ŷţ�д���÷�Ӧ�Ļ�ѧ����ʽ��_______________________________
II.��A�ǵ���ɫ���壬B�����������Ӿ�Ϊ10�������ӣ�������X����ɫ���塣
��4��A��X��Ӧ�Ļ�ѧ����ʽ��_______________________________________
��5����һ����������Xͨ��B����Һ�У���������Һ����μ���ϡ������������������������HCl���ʵ����Ĺ�ϵ��ͼ��ʾ(����������ܽ��HCl�Ļӷ�)��a����Һ���������ʵĻ�ѧʽΪ_________________

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ����ʵ���������й�˵������������

A. ��X�ձ�����ҺΪ�����Ȼ�����Һ�������ù��˵ķ�������Z�ձ��пɻ��������������
B. ��X�ձ�����ҺΪ���Ƶı�����ˮ������ֻ�ձ�Һ���Ư���ԣ�Y��X��Z
C. ��X�ձ�����ҺΪ�����Ȼ�����Һ����X��Z���̵����ӷ�Ӧ����3CaCO3+ 2Fe3+ + 3H2O=2Fe(OH)3+3CO2��+3Ca2+
D. ��X�ձ�����ҺΪ���Ƶı�����ˮ����X��Z���̵����ӷ�Ӧ����2HClO+CO32-=CO2��+O2��+H2O+2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��ѧ��ȤС���ڼ��н��л�ѧʵ�飬����ͼ1���Ӻ���·���ֵ��ݲ���������ͼ2���Ӻ���·���ֵ��������ɴ˵ó��Ľ�����ȷ���ǣ� �� 
A.NaCl�Ƿǵ����
B.NaCl��Һ�ǵ����
C.NaCl��Һ��ˮ���������������
D.NaCl��ˮ��Һ�е�����˿��������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѩ�����������ڷ�Һ������Ч����������ȱ����ƶѪ֢��������Ϊ���е� Fe2�������������
A. ����ѪҺ�����ƽ��
B. ����ѪҺ����ѹ
C. �����ϸ��Ѫ�쵰���γ�
D. �ٽ������ϸ���IJ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ��̽��þ��Ũ����ķ�Ӧ����ͬѧ��Ϊ�����������Ƕ�������������ͬѧ��Ϊ�������������������ܲ���������Ϊ��֤�ס�����ͬѧ���ж��Ƿ���ȷ����ͬѧ��Ƶ�ʵ��װ����ͼ��ʾ��þ����Ũ���Ṳ��ʱ����������ΪX���Ҹ����巢��װ������ȥ����

��1������E��������_____________��
��2��þ����Ũ���Ṳ��ʱ���ɶ�������Ļ�ѧ����ʽΪ_____________��
��3����ͬѧ��Ϊ�����ܲ���������������_____________��
��4��B �м�����Լ���_______����������_____________��
��5��װ��A�з�����Ӧ�����ӷ���ʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ɫ��ѧ�������У�����״̬�Ƿ�Ӧ���е�ԭ��ȫ��ת��Ϊ���ƵõIJ����е�ԭ�ӣ���ԭ��������Ϊ100%�����з�Ӧ�����п���ʵ��ԭ��������Ϊ100%���� �� ��
���û���Ӧ �ڻ��Ϸ�Ӧ �۷ֽⷴӦ �ܸ��ֽⷴӦ ��ȡ����Ӧ �ӳɷ�Ӧ ����ȥ��Ӧ ��Ӿ۷�Ӧ �����۷�Ӧ ��������Ӧ
A.�٢ۢ�B.�ݢߢ�C.�ڢޢ�D.�ڢߢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com