
| A. | Cl- | B. | NO3- | C. | Na+ | D. | CO3- |
科目:高中化学 来源: 题型:解答题
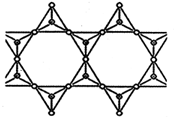 (1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为SiH4+3H2O=4H2+H2SiO3,整个系统还必须与氧隔绝,其原因是SiH4+O2=SiO2+2H2O(用化学方程式表示)
(1)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.制备硅烷整个过程必须严格控制无水,否则生成的硅烷将发生变质,其化学方程式为SiH4+3H2O=4H2+H2SiO3,整个系统还必须与氧隔绝,其原因是SiH4+O2=SiO2+2H2O(用化学方程式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.01×1023个铁原子 | B. | 标准状况下33.6L SO2 | ||
| C. | 1L 1mol/L Na2SO4溶液中的Na+ | D. | 16g氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

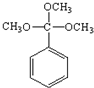 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 铁与水蒸气在高温下的反应产物为Fe2O3和H2 | |
| C. | Fe(OH)2不稳定,在潮湿的空气中很容易被氧化 | |
| D. | 含Fe2+的溶液滴加KSCN后溶液变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
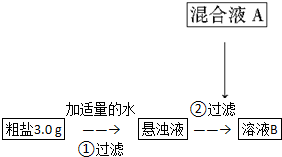
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K+、NO3-、OH- | B. | Na+、Ba2+、Cl-、CO32- | ||
| C. | H+、Zn2+、Cl-、SO42- | D. | K+、Mg2+、NO3-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com