
(14分)锰锌铁氧体可制备隐形飞机上吸收雷达波的涂料。以废旧锌锰电池为原料制备锰锌铁氧体(MnxZn1-xFe2O4)的主要流程如下,请回答下列问题:
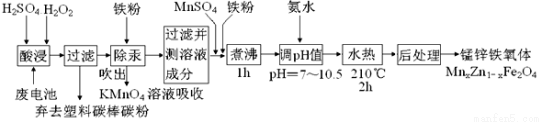
(1)酸浸时,二氧化锰被双氧水还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”或“还原剂”或“吸附剂”)。
(3)除汞是以氮气为载气吹入滤液中,带出汞蒸汽经KMnO4溶液进行吸收而实现的。下图是KMnO4溶液处于不同pH时对应Hg的单位时间去除率变化图,图中物质为Hg与 MnO4- 在该pH范围内反应的主要产物。

①pH<6时反应的离子方程式为 。
②请根据该图给出pH对汞去除率影响的变化规律: 。
③试猜想在强酸性环境下汞的单位时间去除率高的原因: 。(不考虑KMnO4在酸性条件下氧化性增强的因素)
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物的形式表示该锰锌铁氧体的组成 。
(5)经测定滤液成分后,需加入一定量的MnSO4和铁粉,其目的是 。
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:2014-2015广东省佛山市高二下学期第一次月考理化学试卷(解析版) 题型:选择题
下列关于烃的性质的说法中正确的是
A.苯和甲苯都能与硝酸发生苯环上的取代反应
B.苯和甲苯使酸性高锰酸钾溶液褪色
C.苯和己炔都能使溴的四氯化碳溶液褪色
D.苯和乙烷与卤素单质发生取代反应都需要铁作催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c (OH-)>c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
D.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1: 1: 6.下列有关该溶液的判断正确的是
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中摘加稀NaOH溶液,立即出现白色沉淀
C.向该溶液中加入过量铁粉,只发生置换反应
D.若溶液中c(Cl-)=0.6mol/L,则该溶液的pH为1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
B.司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金
C.聚酯纤维、碳纤维、光导纤维都属于有机高分子材料
D.工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.常温下,0.1 mol·L-1 Na2S溶液中存在:c(OH-)=c(H+)+c(HS-)+c(H2S)
B.常温下,0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液恰好完全反应时,溶液中一定存在:c(Na+)=c(A-)>c(OH-)=c(H+)
C.常温下,将0.1 mol·L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中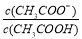 的值增大到原来的10倍
的值增大到原来的10倍
D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)=0.1 mol·L-1:c(Na+)=c(CH3COOH)>c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:实验题
[化学——选修2化学与技术](15分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:

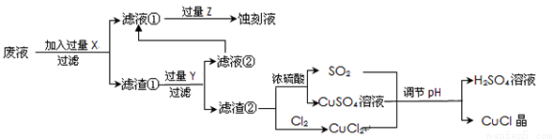
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是_____,现代氯碱工业的装置名称是_____________________。
(2)写出生产过程中X__________Y__________(填化学式)。
(3)写出产生CuCl的化学方程式________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_______________;生产过程中调节溶液的pH不能过大的原因是_____________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是______。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_______。
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ =Fe3+ + Ce3+ 如此再重复二次测得:
1 | 2 | 3 | |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为_________(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知A、B、C、D四种短周期元素,A、D同周期,B、C同主族,简单离子A+、D3+、B2-核外电子排布相同,则下列说法不正确的是
A.A、C、D三种元素最高价氧化物对应的水化物能两两反应
B.离子半径大小:B>A>D>C
C.气态氢化物的稳定性B>C
D.A、B、C三种元素组成的化合物中含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:选择题
下列鉴别方法不可行的是
A.仅用氨水即可鉴别NaCl、AlBr3、FeI2、AgNO3四种溶液
B.用燃烧法鉴别环己醇、苯和四氯化碳
C.用烧碱溶液鉴别地沟油、甘油和石油
D.用新制氯水鉴别碘的淀粉溶液、含石蕊的烧碱溶液、硫酸铜溶液等三种蓝色溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com