
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | / |
分析 向铝灰中加入过量稀H2SO4,A12O3和少量FeO•xFe2O3和硫酸反应生成硫酸铝、硫酸铁、硫酸亚铁,SiO2不反应,过滤除去二氧化硅;向滤液中加入过量KMnO4溶液,高锰酸钾把亚铁离子氧化成铁离子,调节溶液的pH约为3生成氢氧化铁沉淀,除去铁离子,过滤,滤液中含铝离子和过量的高锰酸根离子;加入硫酸锰把过量高锰酸根离子除去,再过滤,对滤液蒸发浓缩、结晶分离出硫酸铝晶体.
(1)依据氧化还原反应电子守恒和原子守恒,结合元素化合价变化分析产物和反应物;
(2)依据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),当c(Fe3+)=1×10-5mol•L-1时,计算出溶液中的氢氧根离子的浓度,据此计算PH值;
(3)①浓盐酸和二氧化锰再加热条件下生成黄绿色气体氯气;
②加入MnSO4至紫红色消失,目的是除去过量高锰酸根离子.
解答 解:(1)反应中MnO4-→Mn2+,Fe2+→Fe3+,MnO4-系数为1,根据电子转移守恒可知,Fe2+系数为$\frac{7-2}{3-2}$=5,由元素守恒可知,Fe3+系数为5,由电荷守恒可知,由H+参加反应,其系数为8,根据元素原子守恒可知,有H2O生成,其系数为4,方程式配平为MnO4-+5 Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:1;5;8H+;1; 5; 4H2O;
(2)依据Ksp[Fe(OH)3]=c(Fe3+)•c3(OH-),当c(Fe3+)=1×10-5mol•L-1时,c(OH-)=$\root{3}{\frac{K{\;}_{sp}[Fe(OH){\;}_{3}]}{c(Fe{\;}^{3+})}}$=$\root{3}{\frac{8.0×10{\;}^{-38}}{1×1{0}^{-5}}}$=2.0×10-11mol•L-1,所以c(H+)=5.0×10-4mol•L-1,PH=3.3,
故答案为:3.3;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
(3)一定条件下,MnO4-可与Mn2+反应生成MnO2
①向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2的现象是生成黄绿色气体;
故答案为:生成黄绿色气体;
②MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去;
故答案为:除去过量的MnO4-.
点评 本题考查了镁、铝、铁及其化合物性质的应用,主要是混合物分离的方法和实验设计,加入氧化剂氧化亚铁离子,调节溶液PH是沉淀分离是解题的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y>X>Z>W | B. | 原子半径:W>X>Z>Y | ||
| C. | 电负性:Y>W>X>Z | D. | 最高正化合价:Y>W>X>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:
如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al箔插入稀HNO3中,无现象,说明Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 工业上电解熔融状态的Al2O3制备Al | |
| C. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 | |
| D. | 铝制容器可盛装浓H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
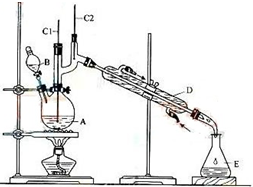 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com