
| A�� | S��g��+O2��g��=SO2��l����|��H|��297.3kJ/mol | |
| B�� | S��g��+O2��g��=SO2��l����|��H|��297.3kJ/mol | |
| C�� | 1mol SO2�ļ����ܺ�С��1mol S��1mol O2����֮�� | |
| D�� | 1mol SO2�ľ��е���������1mol S��1mol O2���е�����֮�� |
���� ������������̬ת���Һ̬��ų������ͷ�Ӧ��=�ϼ����յ�����-�ɼ��ų���������������
��� �⣺A������������̬ת���Һ̬Ҫ�ų�����������S��g��+O2��g��=SO2��l���ķ�Ӧ�ȵľ���ֵ����297.23kJ•mol-1����A��ȷ��
B������������̬ת���Һ̬Ҫ�ų�����������S��g��+O2��g��=SO2��l���ķ�Ӧ�ȵľ���ֵ����297.23kJ•mol-1����B����
C�����ڷ�Ӧ��=�ϼ����յ�����-�ɼ��ų����������ַ�Ӧ�ȡ�H=-297.23kJ/mol��0����1molS��1molO2�ļ����ܺ�С��1molSO2�ļ����ܺͣ���C����
D�����ڷ�Ӧ��=�ϼ����յ�����-�ɼ��ų����������ַ�Ӧ�ȡ�H=-297.23kJ/mol��0����1molS��1molO2�ļ����ܺ�С��1molSO2�ļ����ܺͣ���D����
��ѡA��
���� ������Ҫ�����˻�ѧ��Ӧ�з�Ӧ�ȵļ��㣬��Ҫע�����������̬֮���ת��Ҳ���������ı仯��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
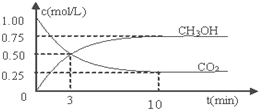
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | W��Ԫ�����ڱ���λ�ڵ������ڵ�IVA�� | |
| B�� | X�������̬�⻯������ȶ��Ա�Y��ǿ | |
| C�� | ��X��Y��Z����Ԫ����ɵ�����ˮ��Һһ���ʼ��� | |
| D�� | ��Y��Z����Ԫ����ɵij������ӻ�������������������Ӹ����ȿ���Ϊ1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ԭ���� | C�� | ������ | D�� | �ܶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ | B�� | ��ԭ�� | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ֱ����1��100nm֮�� | B�� | �������Ӵ���� | ||
| C�� | ���������ܴ�����ֽ | D�� | ���������ܹ����������˶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ͼ�ף������к��ȵIJⶨ | |
| B�� | ͼ�ң��Ƚ� HCl��H2CO3�� H2SiO3 ������ǿ�� | |
| C�� | ͼ������֤ CuCl2�� H2O2 �ֽ��д����� | |
| D�� | ͼ������֤ 2NO2��g��?N2O4��g����H��0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
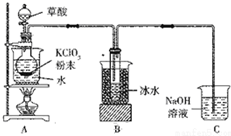 �������ȣ�ClO2����һ�ָ�Ч���������е�Ϊ11�森������ط�ĩ�������60��ʱ��Ӧ�����ɶ������ȵ����ʣ�ʵ��װ����ͼ��ʾ��
�������ȣ�ClO2����һ�ָ�Ч���������е�Ϊ11�森������ط�ĩ�������60��ʱ��Ӧ�����ɶ������ȵ����ʣ�ʵ��װ����ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
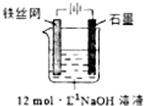 ������أ�K2FeO4����һ�ָ�Ч���ˮ�����������м�ǿ�������ԣ�
������أ�K2FeO4����һ�ָ�Ч���ˮ�����������м�ǿ�������ԣ�| �ɷ� | Fe2O3��KNO3��KOH��ϼ��ȹ��������Ϻ�ɫ�������κ�KNO2�Ȳ��� |
| ʪ�� | ǿ���Խ����У�Fe��NO3��3��NaClO��Ӧ�����Ϻ�ɫ����������Һ |
| ��ⷨ | �Ʊ��м����Na2FeO4������KOH��Һ��Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com