
分析 Al和水不反应,所以剩余金属应该是Al,涉及反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,结合方程式解答该题.
解答 解:(1)Al和水不反应,所以剩余金属应该是Al,则反应的金属共为10g,设Na为xmol,Al为ymol,
反应方程式为2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
由方程式可知x=y,23x+27y=10,
解得x=y=0.2,
则生成氢气的体积为22.4×(0.1+0.3)L=8.96L,
答:放出8.96L氢气;
(2)由方程式可知生成0.2molNaAlO2.向滤液中逐滴加入4mol/L的HCl溶液,最多可生成0.2mol氢氧化铝,质量为0.2mol×78g/mol=15.6g,
涉及方程式为NaAlO2+HCl+H2O=NaCl+Al(OH)3↓,
可知n(HHCl)=0.2mol,
V(HCl)=$\frac{0.2mol}{4mol/L}$=0.05L=50mL,
答;生成沉淀的最大值是15.6g,此时消耗HCl溶液的体积是50mL.
点评 本题考查了有关混合物反应的计算,为高频考点,注意把握反应的相关方程式的书写,充分考查了学生的分析能力及化学计算能力,难度中等.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
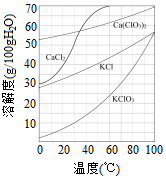 工业上制取氯酸钾的主要步骤为:
工业上制取氯酸钾的主要步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验现象 | ⑦ | ③ | ||
| 实验结论 | ⑥ | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
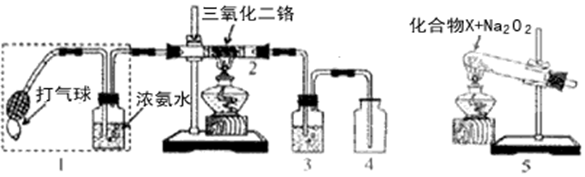
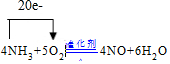 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a≥2b,发生的反应化学方程式为:2C2H2+O2═4C+2H2O | |
| B. | 若($\frac{2}{5}$)b<a<($\frac{2}{3}$)b,燃烧后在密闭容器中加入含amolCa(OH)2的石灰水,发生反应的离子方程式为:OH-+CO2═HCO3- | |
| C. | 若a<($\frac{2}{5}$)b,燃烧过程中转移的电子的物质的量为10amol | |
| D. | 若a=($\frac{1}{2}$)b,燃烧产物既有CO2又有CO,且n(CO2):n(CO)=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
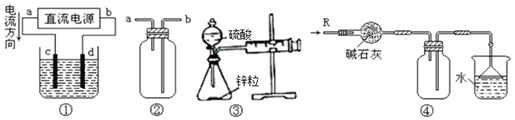
| A. | 装置①中,d为阳极、c为阴极 | |
| B. | 装置②可用于收集H2、NH3、CO2、Cl2、NO2等气体 | |
| C. | 装置③结合秒表可测量锌与硫酸的反应速率 | |
| D. | 装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Na+、SO42-、Cl- | B. | Ba2+、Na+、OH-、SO42- | ||
| C. | OH-、HCO3-、Mg2+、Na+ | D. | K+、Na+、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | B. | 砹(At)的氢化物不稳定 | ||
| C. | 硒的原子半径比硫小 | D. | Sr(OH)2 比Ca(OH)2 碱性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
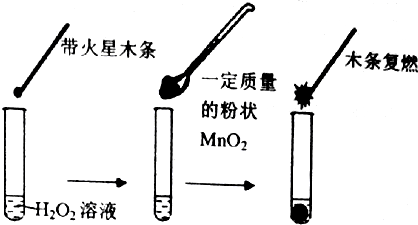
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com