
����Ŀ��1774����仯ѧ�����������̿���Ҫ�ɷ��Ƕ������̣������Ṳ�ȵõ�����ɫ���壮�ס�������ͬѧ�ֱ��ȡ������Ӧԭ��������ȡһƿ��������������֤Cl2��ˮ��Ӧ���ò�������ʣ�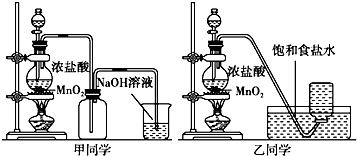
��ش�
��1��д��ʵ�����Ʊ������Ļ�ѧ����ʽ ��
��2��������ͬѧ��ʵ��װ�ã���Ҫֹͣʵ�飬�����˳���� �� ��ֹͣ���� ��ȡ������ƿ�Ǻ� �۽��������뵽�ռ���Һ��
��3���ס�����ͬѧ�ֱ����ռ����������м�������ˮ�������ֳ����ݣ�������֤������ˮ��Ӧ���ò������ʵ�����ʵ�飮ʵ������������ۼ�¼���£�
ʵ����� | ʵ����� | ���� | ���� |
�� | ��Ʒ����Һ | ��Һ��ɫ | ������ˮ��Ӧ�IJ�����Ư���� |
�� | ����NaHCO2��ĩ | ����ɫ���ݲ��� | ������ˮ��Ӧ�IJ�����н�ǿ������ |
������д�±����ۼס���ͬѧʵ��١��ڵĽ��ۣ������������
ʵ����� | �� | �� |
�� | ||
�� |
��4����ͬѧ�������Ϸ���HClO�������Դ���MnO2 �� �������������Լ���ʵ������ȡ����A��CaC12�ʹ�����B��Ũ����NaClO
C��Ũ����ʹ����� D������NaCl������NaClO��Ũ����
����Ϊ���������Լ������Լ�����ʵ�ʣ���Cl��ԭ����������ߣ���д�������Ӧ�Ļ�ѧ����ʽ ��
���𰸡�
��1��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O
MnCl2+Cl2��+2H2O
��2���ڢۢ�
��3��������������������������
��4��D��NaCl+NaClO+H2SO4�TNa2SO4+H2O+Cl2����������Na2SO4Ҳ��д��NaHSO4��
���������⣺��1��ʵ����������Ͷ��������ڼ��������·�Ӧ�Ʊ���������Ӧ�ķ���ʽΪ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�� �ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O�� �ʴ�Ϊ��MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O����2�������ж������ŷŵ������У���ֹͣ����������������������ͬѧ��ʵ��װ�ã�Ҫֹͣʵ�飬�����˳��Ϊ����ȡ������ƿ�������������ͨ���������ƣ����ֹͣ���ȣ�
MnCl2+Cl2��+2H2O����2�������ж������ŷŵ������У���ֹͣ����������������������ͬѧ��ʵ��װ�ã�Ҫֹͣʵ�飬�����˳��Ϊ����ȡ������ƿ�������������ͨ���������ƣ����ֹͣ���ȣ�
�ʴ�Ϊ���ڢۢ٣���3����ͬѧ�������ſ������ռ���������Ϊ�Ȼ�����лӷ��ԣ������ռ��������к��д������Ȼ��⣬�Ȼ�����̼�����Ʒ�Ӧ���ɶ�����̼���壬����ˮ�ɷֵļ�����ɸ��ţ���ͬѧ�Ʊ������������Ȼ��ⲻ�����ˮ�е��Ȼ���ļ�����ɸ��ţ�
�ʴ�Ϊ��
ʵ����� | �� | �� |
�� | ���� | ���� |
�� | ������ | ���� |
4��A��CaC12�ʹ����ᣬ������Ϊ���ᣬ��������������٣������Լ�������ʵ�ʣ�
B��Ũ����NaClO������Һ�У���������ˮ��ԭ�������ʵͣ������Լ�������ʵ�ʣ�
C��Ũ����ʹ����ᣬ������Ϊ���ᣬ��������������٣�����Һ�У���������ˮ��ԭ�������ʵͣ������Լ�������ʵ�ʣ�
D������NaCl������NaClO��Ũ���ᣬŨ���Ậˮ�����٣�������䷴Ӧ��ȡ��������ԭ�������ʸߣ���ӦΪ��NaCl+NaClO+H2SO4�TNa2SO4+H2O+Cl2����������Na2SO4Ҳ��д��NaHSO4������D����ʵ�ʣ�
�ʴ�Ϊ��D��NaCl+NaClO+H2SO4�TNa2SO4+H2O+Cl2����������Na2SO4Ҳ��д��NaHSO4����
��1������Ͷ��������ڼ��������·�Ӧ�����������Ȼ��̺�ˮ����2������ʵ�������ȫ��β������Ҫ����ͬѧֹͣʵ��Ӧ��ȡ������ƿ�������������ͨ���������ƣ����ֹͣ���ȣ���3����ͬѧ�������ſ������ռ���������Ϊ�Ȼ�����лӷ��ԣ������ռ��������к��д������Ȼ��⣬�Ȼ�����̼�����Ʒ�Ӧ���ɶ�����̼���壬����ˮ�ɷֵļ�����ɸ��ţ���ͬѧ�Ʊ������������Ȼ��ⲻ�����ˮ�е��Ȼ���ļ�����ɸ��ţ���4��A��CaC12�ʹ����ᣬ������Ϊ���ᣬ��������������٣�
B��Ũ����NaClO������Һ�У���������ˮ��ԭ�������ʵͣ�
C��Ũ����ʹ����ᣬ������Ϊ���ᣬ��������������٣�����Һ�У���������ˮ��ԭ�������ʵͣ�
D������NaCl������NaClO��Ũ���ᣬ��ԭ�������ʸߣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ӦaA��g��+bB��g��cC��g����H=Q ���ܱ������н��У��ڲ�ͬ�¶ȣ�T1��T2 ����ѹǿ��P1 ��P2 ���£����������B����������w
A.�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ�������ж���ȷ���ǣ� �� 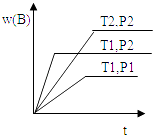
B.T1��T2 �� P1��P2 �� a+b��c��Q��0
C.T1��T2 �� P1��P2 �� a+b��c��Q��0
D.T1��T2 �� P1��P2 �� a+b��c��Q��0
E.T1��T2 �� P1��P2 �� a+b��c��Q��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У���Ӧ�����뷴Ӧ�������ı�ʱ��Ӱ���䷴Ӧ�������(����)
A. Na+O2B. C+O2C. CO2+Ca(OH)2D. Na2O2+CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɵ���A�뻯����B���ַ�ĩ��ɵĻ����, ��һ�������¿ɰ���ͼ��ʾ����ת��:
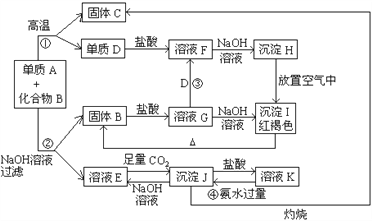
��ش�
��1��A�Ļ�ѧʽ____________; B�Ļ�ѧʽ_____________
��2����Ӧ�ٵĻ�ѧ����ʽ_____________________________________________
��3��������ҺF�������ӵķ�����_________________________________
��4����Ӧ�۵����ӷ���ʽ_____________________________________________
��5����Ӧ�ܵ����ӷ���ʽ_____________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ķ���������40 mL 10 mol/LŨ���ᷴӦ����������ͬ0.1 mol����������������Ũ���ᷴӦ�������������(����)
A. ǰ�߲�����Cl2�� B. ���߲�����Cl2��
C. һ���� D. ���Ƚ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����(����)
A. ����������һ���Ǽ���������
B. �ǽ���������һ��������������
C. ����������һ���Ƿǽ���������
D. ����������һ���ǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ�����ã�
��1�����̼�Ȼ�ԭ���Ȼ�����ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
2Al2O3��s��+2AlCl3��g��+6C��s���T6AlCl��g��+6CO��g����H=akJmol��1
3AlCl��g���T2Al��l��+AlCl3��g����H=bkJmol��1
��ӦAl2O3��s��+3C��s���T2Al��l��+3CO��g���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+2NO��g��N2��g��+CO2��g����H=QkJmol��1 �� ��T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
ʱ�䣨min�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��0��10min�ڣ�NO��ƽ����Ӧ����v��NO��= �� T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı������������������ĸ��ţ���
a��ͨ��һ������NO
b������һ�����Ļ���̿
c��������ʵĴ���
d���ʵ���С���������
����30min�������¶���T2�棬�ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��1����Q0���������������
���ھ��Ⱥ��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬������������ѡ���ţ���
a����λʱ��������2nmol NO��g����ͬʱ����nmol CO2��g��
b����Ӧ��ϵ���¶Ȳ��ٷ����ı�
c�����������ܶȲ��ٷ����ı�
d����Ӧ��ϵ��ѹǿ���ٷ����ı䣮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��
��CaCO3��s���TCaO+CO2��g����H=+177.7kJ
��C��s��+H2O��s���TCO��g��+H2��g����H=��131.3kJmol��1
�� ![]() H2SO4��1��+NaOH��1���T
H2SO4��1��+NaOH��1���T ![]() Na2SO4��1��+H2O��1����H=��57.3kJmol��1
Na2SO4��1��+H2O��1����H=��57.3kJmol��1
��C��s��+O2��g���TCO2��g����H=��393.5kJmol��1
��CO��g��+ ![]() O2��g���TCO2��g����H=��283kJmol��1
O2��g���TCO2��g����H=��283kJmol��1
��HNO3��aq��+NaOH��aq���TNaNO3��aq��+H2O��1����H=��57.3kJmol��1
��2H2��g��+O2��g���T2H2O��1����H=��517.6kJmol��1
��1�������Ȼ�ѧ����ʽ�У�����ȷ���� �� ����ȷ�����ɷֱ���
��2������������Ϣ��д��Cת��ΪCO���Ȼ�ѧ����ʽ�� ��
��3��������Ӧ�У���ʾȼ���ȵ��Ȼ�ѧ����ʽ������ʾ�к��ȵ��Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴ӦmA��g��nB��g��+pC��s����H=Q���¶Ⱥ�ѹǿ�ı仯�������淴Ӧ���ʵ�Ӱ��ֱ����ͼ�е�����ͼ������������ȷ���ǣ� �� 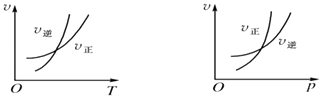
A.m��n��Q��0
B.m��n+p��Q��0
C.m��n��Q��0
D.m��n+p��Q��0
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com