
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
分析 Ⅰ.(1)量取25.00mL废液于250mL锥形瓶中,分别加入5mL 2mol•L-1 H2SO4和10mL 20% Fe2(SO4)3溶液,铁离子氧化碘离子为单质碘,硫酸抑制铁离子的水解;
(2)取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500mol•L-1标准K2Cr2O7溶液进行滴定到终点.重铬酸钾在酸性溶液中氧化亚铁离子为铁离子;
(3)依据氧化还原反应定量关系计算,2Fe3++2I-=2Fe2++I2,6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,6I-~6Fe2+~Cr2O72-;3次测定溶液体积第3次误差大舍去;
(4)依据滴定过程分析,误差主要是标准溶液体积变化引起,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$;
Ⅱ.(5)利用实验①验证硝酸根离子在酸性溶液中和银不发生反应;
(6)有白色沉淀生成,生成是氯化钠和硝酸银生成的氯化银白色沉淀,证明铁离子氧化银单质生成银离子;
(7)向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液,紫红色不褪去说明溶液中无亚铁离子,说明亚铁离子和银离子发生反应生成铁离子和银;
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关.
解答 解:Ⅰ.(1)在盛有废液的锥形瓶中先加入5mL 2mol•L-1 H2SO4的目的是:溶液中铁离子水解溶液显酸性,Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4平衡逆向移动,抑制Fe3+水解,
故答案为:Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4平衡逆向移动,抑制Fe3+水解;
(2)取下锥形瓶冷却后,加入几滴二苯胺磺酸钠(用作指示剂),用0.02500mol•L-1标准K2Cr2O7溶液进行滴定到终点.重铬酸钾在酸性溶液中氧化亚铁离子为铁离子,上述过程中涉及的反应:①2Fe3++2I-═2Fe2++I2 ,②6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,
故答案为:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(3)依据氧化还原反应定量关系计算,2Fe3++2I-=2Fe2++I2,6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,6I-~6Fe2+~Cr2O72-;3次测定溶液体积第3次误差大舍去与,消耗溶液体积为V=$\frac{19.98+20.02}{2}$ml=20.00ml,
6I-~6Fe2+~Cr2O72-,
6 1
n 0.02500mol•L-1×0.0200L
n=0.003mol,
该废液中I-含量=$\frac{0.03mol×127g/mol}{0.025L}$=15.24g/L,
故答案为:15.24;
(4)依据滴定过程分析,误差主要是标准溶液体积变化引起,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,
A.终点读数时俯视读数,滴定前平视读数,读取的标准溶液体积减小,测定结果偏低,故A正确;
B.锥形瓶水洗后未干燥,对待测液的溶质无影响,故B错误;
C.滴定管未用标准K2Cr2O7溶液润洗,消耗标准溶液体积增大,测定结果偏高,故C错误;
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡.读取标准溶液体积增大,测定结果偏高,故D错误;
故答案为:A;
Ⅱ.(5)利用实验①验证硝酸根离子在酸性溶液中和银不发生反应,设计实验①的目的是排除NO3-的干扰,
故答案为:排除NO3-的干扰;
(6)向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液,有白色沉淀生成,生成是氯化钠和硝酸银生成的氯化银白色沉淀,证明铁离子氧化银单质生成银离子,说明Fe3+能氧化Ag,
故答案为:Fe3+能氧化Ag;
(7)向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液,紫红色不褪去说明溶液中无亚铁离子,说明亚铁离子和银离子发生反应生成铁离子和银,反应的离子方程式为:Fe2++Ag+?Fe3++Ag,
故答案为:Fe2++Ag+?Fe3++Ag;
(8)根据以上实验,Fe3+和Ag+的氧化性相对强弱与离子浓度有关,
故答案为:浓度.
点评 本题考查了物质组成和成分的实验探究方法和过程分析判断,主要是物质性质和反应现象的理解应用,掌握基础是解题关键,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
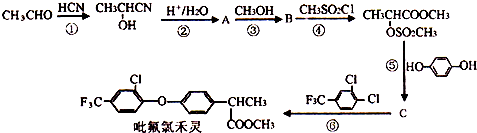
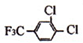 +
+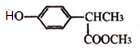 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$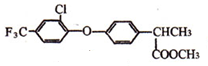 +HCl.
+HCl. .
.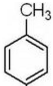 制备高分子化合物
制备高分子化合物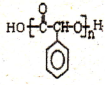 的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.
的合成路线流程图(无机试剂任选),合成流程示意图如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}}$CH2═CH2$→_{催化剂△}^{H_{2}}$CH3CH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1L0.50mol/LNH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得标准状况下1.12LO2,转移电子数目为0.2NA | |
| D. | 28g分子式为CnH2n的链烃中含有的C-H键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖可用于合成葡萄糖到钙口服液 | |
| B. | 工业制普通玻璃的原料是石英、纯碱、石灰石 | |
| C. | 月饼包装盒中常放入生石灰或硅胶做干燥剂,铁粉或硫酸亚铁做抗氧化剂 | |
| D. | 原子利用率=期望产物的原子总数与生成物原子总数之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
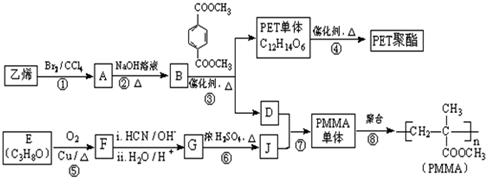
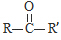 $\underset{\stackrel{i.HCN/O{H}^{-}}{→}}{ii.{H}_{2}O/{H}^{+}}$
$\underset{\stackrel{i.HCN/O{H}^{-}}{→}}{ii.{H}_{2}O/{H}^{+}}$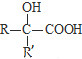 (R、R′代表烃基)
(R、R′代表烃基)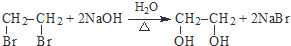 .
.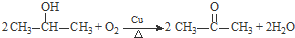 .
. .
.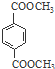 与足量NaOH溶液反应时,最多消耗4mol NaOH
与足量NaOH溶液反应时,最多消耗4mol NaOH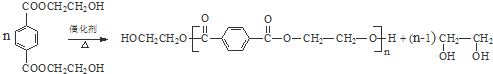 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号是零族元素 | B. | 第七周期共有32种元素 | ||
| C. | 四种元素都有放射性 | D. | 四种元素都是金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
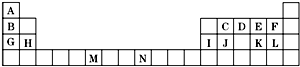 如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com