
| A. | 将NaHCO3固体加入新制氯水,有无色气泡生成(H+) | |
| B. | 使红色布条褪色(HClO) | |
| C. | 向NaBr溶液中滴加氯水,再滴加CCl4,发现下层为橙红色(HCl) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
分析 氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答.
解答 解:A.氯水显酸性,氯气和水反应生成元素和次氯酸,盐酸能与碳酸氢钠反应生成CO2气体,故A不选;
B.次氯酸具有强氧化性,能氧化有色布条,故B不选;
C.向NaBr溶液中滴加氯水,是氯气氧化了溴离子为Br2,再滴加密度大于水的CCl4,发现下层为橙红色,与HCl无关,故C选.
D.氯离子和硝酸银反应生成氯化银白色沉淀,故D不选;
故选C.
点评 本题考查氯气的性质,侧重于氯水的组成和性质的考查,为高频考点,难度中等,注意把握相关物质的性质.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | HBrO3 | B. | XeF2 | C. | HBrO4 | D. | Xe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
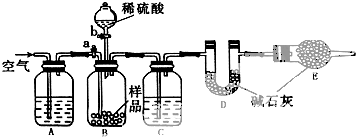
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④ | B. | ③②①④ | C. | ③①④② | D. | ③①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+和Na+ | B. | Al3+和Cl- | C. | OH-和NH4+ | D. | H2S和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
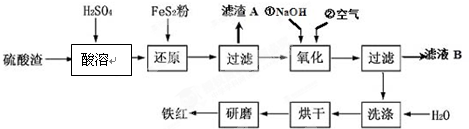
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com