
下列说法正确的是( )
A.常温下,醋酸钠与醋酸的混合溶液PH=7,C(Na+)>c(CH3COO-)
B.0.1mol/LNa2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
C.将PH=6的H2SO4稀释1000倍后,c(H+)=2c(SO42-)
D.0.1mol/LNaHCO3溶液中:c(Na+)+c(H+)= c(HCO3-)+ c(OH-)+2c(CO32-)
D
【解析】
试题分析:A.根据电荷守恒可得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于常温下,醋酸钠与醋酸的混合溶液PH=7,所以c(H+)=c(OH-),故c(Na+)=c(CH3COO-),错误;B.0.1mol/LNa2CO3溶液中,根据物料守恒可得:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),错误;C.将PH=6的H2SO4稀释1000倍后,酸电离产生的H+的浓度是硫酸根的2倍,在溶液中还存在水电离产生的H+,所以,c(H+)>2c(SO42-),错误;D.0.1mol/LNaHCO3溶液中,根据电荷守恒可得:c(Na+)+c(H+)= c(HCO3-)+ c(OH-)+2c(CO32-),正确。
考点:考查守恒法在比较离子浓度的大小的应用的知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)
(1)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应正极电极反应式为_______;放电时,CO32-移向电池的______(填“正”或“负”)极。
(2)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(3)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是__________(用离子方程式和必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考B层化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA
B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:填空题
(10分)10000C时,硫酸钠可与氢气发生反应: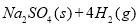

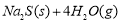 。请回答下列问题:
。请回答下列问题:
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,其中H2的浓度随时间的变化如图所示。
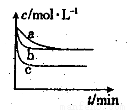
①与曲线a比较,b和c分别仅改变一种反应条件,则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”),其判断理由是 。
(3)该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得固体质量为1.10g。则该时间范围内的平均反应速率v(H2)= 。
(4)能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内压强保持不变 B.容器内气体密度保持不变
C.c(H2)=c(H2O) D.v正(H2)=v逆(H2O)
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:选择题
可逆反应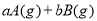
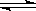
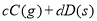
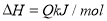 ,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
,反应过程中,当其他条件不变时,C在混合物中的含量与温度(T)的关系如图I所示,反应速率(v)与压强(p)的关系如图II所示。据图分析,以下说法正确的是( )
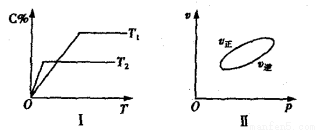
A.T1<T2,Q>0 B.增大压强,物质B的转化率增大
C.反应达平衡后,增加少量的D,平衡逆向移动 D.a+b>c+d
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH -
B.铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S) -2e - + 2H2O(l)=PbO2(S) + 4H+(aq)+ SO42-(aq)
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- = Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - = Fe2+
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高一9月月考化学试卷(解析版) 题型:填空题
对于混合物的分离或提纯,常采用的方法有:①过滤、②蒸发、③蒸馏、④萃取、⑤加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填序号)
(1)提取碘水中的碘 ___________ (2)除去食盐溶液中的水 ___________
(3)淡化海水 (5)KCl中含有KClO3
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西四校9月联考高二化学试卷(解析版) 题型:填空题
(12分)氨是最重要的氮肥,是产量最大的化工品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或 “等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源:2014秋贵州省遵义市高二上学期期中化学(文)试卷(解析版) 题型:选择题
碘酒是一种常用的外用消毒药,关于它的消毒原理说法正确的是
A.溶解细菌 B.氧化细菌,使蛋白质变性
C.使细菌缺氧而死 D.使细菌缺水而死
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com