
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.78g苯中含有的碳碳双键数目为3NA
D.1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目 为0.1NA
为0.1NA
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )
A.10℃ 20 mL 3 mol·L-1的X溶液
B.20℃ 10 mL 4 mol·L-1的X溶液
C.20℃ 30 mL 2 mol·L-1的X溶液
D.10℃ 10 mL 2 mol·L-1的X溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:选择题
在300 mL密闭容器中,放入镍粉并充入一 定量的CO气体,一定条件下反应Ni(s)+4CO(g)
定量的CO气体,一定条件下反应Ni(s)+4CO(g)  Ni(CO)4(g)。已知该反应的平衡常数与温度的关系如下:
Ni(CO)4(g)。已知该反应的平衡常数与温度的关系如下:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法中不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25 ℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 m ol·L-1
ol·L-1
D.80 ℃时,测得其时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源:2017届云南师大附中高三上月考三化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验Fe(NO3)2样品已被氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 |
B | 提取碘水中碘 | 将碘水倒入分液漏斗,加入适量乙醇,振荡后静置 |
C | 验证Mg(OH)2沉淀可以转化为 Fe(OH)3沉淀 | 向 2 mL1mol·L-1NaOH 溶液中加入2 ~3 滴 lmol·L-1MgCl2溶液,生成白色沉淀,再加入2~3滴lmol·L-1FeCl3溶液 |
D | 比较碳和硅的非金属性强弱 | 向饱和的Na2SiO3溶液中通人CO2 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上综合测试三化学卷(解析版) 题型:实验题
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:所用酸性KMnO4溶液的浓度可选择0.010 mol•L-1、0.0010 mol•L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10 mol•L-1)的用量均为4 mL。
(1)写出反应的离子方程式:
(2)请完成以下实验设计表:完成④的实验条件,并将实验目的补充完整。
实验 编号 | T/K | 催化剂的用量 / g | 酸性KMnO4溶液的浓度/mol•L-1 | 实验目的 |
① | 298 | 0.5 | 0.010 | a. 实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和③探究 对反应速率的影响 c. 实验①和④探究催化剂对反应速率的影响。 |
② | 298 | 0.5 | 0.001 | |
③ | 323 | 0.5 | 0.010 | |
④ |
(3)该反应的催化剂选择MnCl2还是MnSO4 ,简述选择的理由 。
(4)某同学对实验①和②分别进行了三次实验,测得以下数据(从混合振荡均匀开始计时):
实验编号 | 溶液褪色所需时间 t / min | ||
第1次 | 第2次[ | 第3次 | |
① | 12.8 | 13.0 | 11.0 |
② | 4.9 | 5.1 | 5.0 |
a、实验②中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
b、该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液浓度越小,所需时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。
C、某同学认为不用经过计算,直接根据褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为应该如何设计实验 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西西安市高三上模拟三化学试卷(解析版) 题型:填空题
氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1) 可逆反应N2+3H2 2NH3是工业上合成氨的重要反应
2NH3是工业上合成氨的重要反应
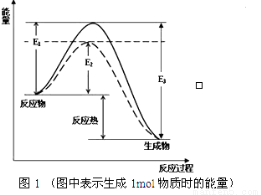
根据图1请写出合成氨的热化学方程式:_______________(热量用E1、E2或E3表示)。
(2)LiAlH4是一种重要的储氢载体,能与水反应达到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为__________。
(3)氮化锂是非常有前途的储氢材料,其在氢气中加热中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2 LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
LiNH2+2LiH,氧化产物为_________(填化学式),在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的_________%(精确到0.1)。
(4)LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠,已知电池放电时总反应式为FePO4+Li═LiFePO4 ,电池正极反应为____________________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物)。
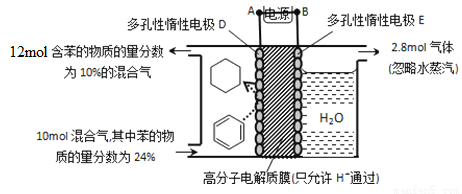
①导线中电子移动方向为____________。(用A、D表示)
②生成目标产物的电极反应式为__________________________。
③该储氢装置的电流效率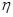 =__________________________。
=__________________________。
( =
= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2017届陕西西安市高三上模拟三化学试卷(解析版) 题型:选择题
下列物质的除杂方案正确的是
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | CO2(g) | SO2(g) | 饱和Na2CO3溶液、浓H2SO4 | 洗气 |
B | NH4Cl(ap) | Fe3+(ap) | NaOH溶液 | 过滤 |
C | NaCl(s) | KNO3(g) | AgNO3溶液 | 过滤 |
D | Cu(s) | Ag(s) | CuSO4 | 电解法 |
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上期中化学试卷(解析版) 题型:选择题
某溶液可能含有Cl-、SO 、CO
、CO 、NH
、NH 、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO 、NH
、NH 一定存在,Cl-可能不存在
一定存在,Cl-可能不存在
D.CO 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二上学期期中化学试卷(解析版) 题型:填空题
空气和水是人类生存和发展必不可少的自然资源,改善空气质量、合理利用水资源已成为全人类共识。
⑴今年9月以来北京地区发生严重雾霾天气,其中9月28日,各种污染物的污染指数为:二氧化硫86,二氧化氮71,可吸入颗粒物162,则该地区的空气污染指数为 ,首要污染物为 。
⑵汽车上加装尾气催化净化装置,可以使NO、CO相互反应转化为两种非污染性气体,写出该反应的化学反应方程式________________ 。
⑶明矾可用作废水处理的 剂,Al3+水解生成的 (填化学式)胶体能吸附水中的悬浮颗粒,并使之沉降。
⑷煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是 (填化学式)。在煤中加入适量石灰石,可以大大减少煤燃烧时SO2的排放,发生反应的化学方程式为 。(请写出其总反应方程式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com