
| 7.40g |
| 74g/mol |
| 0.165g |
| 74g/mol |
| 0.00223mol×2 |
| 0.1L |
| 7.40g |
| 74g/mol |


科目:高中化学 来源: 题型:

| A、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| B、通入甲烷气体的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O |
| C、若左池石墨电极产生22.4L气体,则消耗0.25 mol甲烷 |
| D、铁电极的电极反应式为:Fe-3e-=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧的摩尔质量是32 g?mol-1 |
| B、CO32-摩尔质量是60 g/mol |
| C、CO2的相对分子质量是44g |
| D、硫酸的摩尔质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||||||||
| B、11.7g食盐晶体中的分子数为0.2×6.02×10-23 | ||||||||||
| C、等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多 | ||||||||||
| D、根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
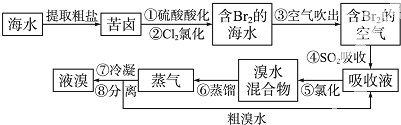
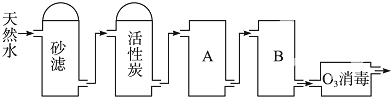
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)材料是人类赖以生存和发展的重要物质基础.
(1)材料是人类赖以生存和发展的重要物质基础.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com