

分析 9gH2O的物质的量为$\frac{9g}{18g/mol}$=0.5mol,0.1mol烃A与足量的氧气完全反应生成0.4molCO2和9gH2O,则有机物的分子式为C4H10,A中有三个甲基,应为CH3CH(CH3)2,分子B中只有一个官能团,且C能被高锰酸钾氧化,应为伯醇,则B为CH2ClCH(CH3)2,C为CH2OHCH(CH3)2,D为(CH3)2CHCOOH,以此解答该题.
解答 解:9gH2O的物质的量为$\frac{9g}{18g/mol}$=0.5mol,0.1mol烃A与足量的氧气完全反应生成0.4molCO2和9gH2O,则有机物的分子式为C4H10,A中有三个甲基,应为CH3CH(CH3)2,分子B中只有一个官能团,且C能被高锰酸钾氧化,应为伯醇,则B为CH2ClCH(CH3)2,C为CH2OHCH(CH3)2,D为(CH3)2CHCOOH,
(1)由以上分析可知A为CH3CH(CH3)2,发生取代反应生成B,故答案为:CH3CH(CH3)2;取代反应;
(2)C为CH2OHCH(CH3)2,D为(CH3)2CHCOOH,二者可发生酯化反应,方程式为(CH3)2CHCOOH+CH2OHCH(CH3)2$→_{△}^{浓硫酸}$(CH3)2CHCOOCH2CH(CH3)2+H2O,
故答案为:(CH3)2CHCOOH+CH2OHCH(CH3)2$→_{△}^{浓硫酸}$(CH3)2CHCOOCH2CH(CH3)2+H2O.
点评 本题考查有机物推断,为高频考点和常见题型,计算确定A的分子式,结合转化关系确定B的结构为解答该题的关键,较好的考查学生的分析推理能力,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的电子层数都相同 | |
| B. | 同主族元素的最外层电子数不一定相同 | |
| C. | 最外层电子数相同的元素都在同一族 | |
| D. | 周期表是按相对原子质量逐渐增大的顺序从左到右排列的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 事 实 | 解 释 |
| A | 金属镁燃烧不能用CO2来扑灭 | 镁与CO2要反应 |
| B | 一滴水中大约有1.67×1021个水分子 | 水分子很小 |
| C | 敞口容器中的酒精逐渐减少 | 分子是不断运动的 |
| D | 遭到核辐射后要多吃含“碘”食物 | 碘元素能屏蔽核辐射 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
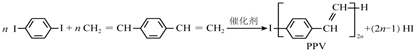
| A. | 合成PPV的反应为加聚反应 | |
| B. | PPV与聚苯乙烯具有相同的重复结构单元 | |
| C. |  和苯乙烯互为同系物 和苯乙烯互为同系物 | |
| D. | 1mol 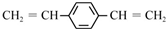 最多可以和5mol氢气发生加成反应 最多可以和5mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H6 | C. | C4H10 | D. | C3H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
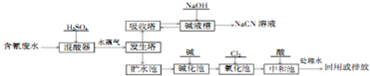
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com