
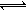 3HF △H>0, H2F2
3HF △H>0, H2F2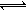 2HF △H>0。
2HF △H>0。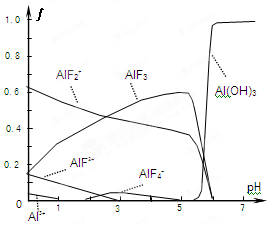
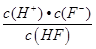 ,溶液pH=4,则溶液中c(H+)=10-4 mol?L-1,所以平衡时c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1,c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1,代入电离平衡常数计算;
,溶液pH=4,则溶液中c(H+)=10-4 mol?L-1,所以平衡时c(HF)=(0.10-1×10-4) mol?L-1≈0.10 mol?L-1,c(F-)=(0.10+1×10-4)mol?L-1≈0.10mol?L-1,代入电离平衡常数计算; H++F-
H++F-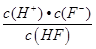 =
=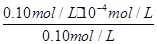 =1.0×10-4 mol?L-1,
=1.0×10-4 mol?L-1,

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
| pH范围 | 大于7 | 小于7 |
| 产物 | NO | NO、N2O、N2中的一种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.mol·L-1 | B.× mol·L-1 |
| C.× mol·L-1 | D.mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.20mL | B.25mL | C.28mL | D.33mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
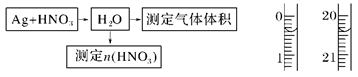
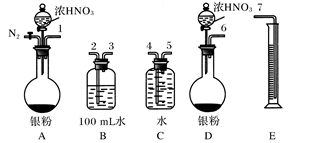
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1 | B.3:2 | C.2:1 | D.4:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
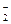 +xI-+yH+=bNO↑+cI2+zH2O,
+xI-+yH+=bNO↑+cI2+zH2O,查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.N2与H2在一定条件下反应生成NH3 | B.NO与O2反应生成NO2 |
| C.由NH3制NH4HCO3和(NH4)2SO4 | D.NH3经催化氧化生成NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com